材料与血液的相爱相杀:葛均波、顾臻、张先正、聂广军、王浩、王磊、张振中等人近期研究进展!
 NanoLabs
NanoLabs
2020-06-04
转眼间,就到了2020年的6月了,一年已将近一半,这期给大家带来的顶刊趋势是关于材料与血液相互作用的精选论文,更具体来讲,就是材料用于溶解血栓,或是利用血栓来扼杀肿瘤,下面为具体的内容:
(由于往期比较多了,所以本期文末就不放入口链接啦,部分往期内容可点击上方专辑查看)
一、化害为利,利用血栓扼死肿瘤
1. Science Advances:基于自组装肽的生物模拟血小板引发人工凝血
血小板在凝血调节中起着至关重要的作用,凝血是生命中必不可少的过程之一,引起了人们的极大关注。然而,由于凝血过程的复杂性,模拟血小板用于体内人工凝血仍然是一个巨大的挑战。在此,国家纳米科学中心王浩、王磊等人设计了基于自组装肽的血小板样纳米颗粒(pNPs),这些肽可以在血管中引发凝血并形成凝块。
本文要点:
1)pNPs首先与肿瘤部位血管生成内皮细胞过度表达的膜糖蛋白(即CD105)特异性结合,同时通过配体-受体相互作用转化为活化的血小板样纳米纤维(apNFs)。
2)接下来,apNFs暴露更多的结合位点,招募并激活更多的pNPs,在体模和动物模型中形成人工凝块。
3)pNPs在小鼠身上被证明是安全的,没有全身凝血。
这种自组装肽可以模拟血小板,在体内实现人工凝血,从而为肿瘤的治疗提供了一种很有前途的策略。

Pei-Pei Yang, et al. A biomimetic platelet based on assembling peptides initiates artificial coagulation, Sci. Adv., 2020.
DOI: 10.1126/sciadv.aaz4107
http://advances.sciencemag.org/content/6/22/eaaz4107
2. ACS Nano:肽基纳米颗粒在肿瘤血管内特异性模拟层粘连蛋白纤维形成抑制肿瘤生长
基于血管生成的肿瘤治疗策略受到基础研究和临床研究的高度重视。通过阻断肿瘤内的血管来阻断肿瘤细胞的氧气和营养供应可以抑制肿瘤的生长。在此,国家纳米科学中心王浩、王磊,北京科技大学曹晖等人报道了一种基于双响应肽的纳米颗粒,它能在肿瘤血管中特异地高效地模拟层粘连蛋白纤维生成,从而导致肿瘤血管的阻塞和肿瘤的生长抑制。
本文要点:
1)层粘连蛋白模拟肽(LMMP)具有纤颤序列、pH响应序列和靶向序列。
2)纳米制剂中的LMMP被输送到肿瘤中的血管,肿瘤血管微环境(pH和微血栓)使LMMP能够进一步层粘连蛋白纤维生成,构建纤维网络。层粘连蛋白样纤维网络捕获红细胞等,特异性地在肿瘤血管形成阻塞,从而抑制肿瘤的生长。

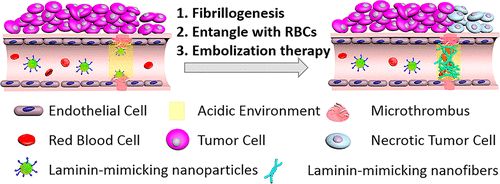
Kuo Zhang, et al. Peptide-Based Nanoparticles Mimic Fibrillogenesis of Laminin in Tumor Vessels for Precise Embolization, ACS Nano, 2020.
DOI: 10.1021/acsnano.0c02110
https://doi.org/10.1021/acsnano.0c02110
3. ACS Nano:模拟生物趋向性靶向血管破坏肿瘤,用于缺氧敏感治疗
肿瘤血管系统在维持肿瘤生长中起关键作用。血管破裂伴随着内部凝血,血小板的聚集和由此产生的氧供应的抑制。在此,武汉大学张先正和冯俊等人人为地创建了这一生理过程,以建立血管中断和模拟血小板的生物趋化之间的相互反馈,用于缺氧依赖治疗的级联扩增。
本文要点:
1)为了证明这一概念,将介孔二氧化硅纳米颗粒与缺氧激活的前药(HAP)和血管破坏剂共负载,然后涂覆血小板膜。一旦进入肿瘤,此纳米疗法可以破坏局部血管从而抑制肿瘤。这种血小板膜包覆的纳米平台与亲代血小板共享出血倾向性功能,并且可以被血管破裂的肿瘤持续聚集。
2)通过这种方式,肿瘤内血管破裂和肿瘤靶向在生物学上是相互依赖和相互加强的。依靠这种相互反馈,肿瘤缺氧被极大地促进了20倍以上,说明了HAP的细胞毒性得到了有效恢复。
因此,此受生物启发的纳米设计通过肿瘤内血管破裂、模拟血小板的生物趋化、级联低氧扩增和低氧敏感化疗之间的生物驱动合作,表现出高度特异性和有效的抗肿瘤效力。这项研究提供了将治疗设计与生理事件相关联以实现更好的治疗效果的范例。


Mingkang Zhang, Jing-Jie Ye, Yu Xia, et al. Platelet-Mimicking Biotaxis Targeting Vasculature-Disrupted Tumors for Cascade Amplification of Hypoxia-Sensitive Therapy. ACS Nano, 2019.
https://doi.org/10.1021/acsnano.9b07330
二、润物无声,保护卒后损伤
4. JACS:一种克服体内缺血性卒中损伤的金属协同抗氧化策略
氧化应激是缺血性脑卒中的标志之一。基于过氧化氢酶(CAT)的生物模拟复合物有望作为缺血性脑卒中的神经保护剂,通过降低H2O2的损伤效应而成为具有较大前景的治疗候选药物。不幸的是,这些分子会产生有害的羟基自由基HO·。在此,北京大学张俊龙、德克萨斯大学奥斯汀分校Jonathan L. Sessler、北京大学第一医院康磊等人报告了一系列基于Salen的三锰(Mn(III))金属配合物(1-3),它们具有模拟过氧化氢酶的功能。
本文要点:
1)这些笼状分子包含一个独特的“活性位点”,三个Mn中心非常接近,这种排列设计能促进金属的协同作用,以最小限度地产生HO·,从而有效地歧化H2O2。
2)事实上,与单体Mn(Salen)配合物1c相比,1-3的产氧量显著增加。
3)对最有前景的体系1进行了更详细的研究,发现在体外和体内都比单体控制系统1c具有更大的治疗效益,这从涉及缺血性脑卒中损伤的大鼠模型和支持组织学分析的研究中可见一斑。
综上所述,金属配合物 1及其类似物代表了一种治疗氧化应激相关疾病的新的、有前景的策略。


Yingying Ning, et al. Tri-Manganese(III) Salen-Based Cryptands: A Metal Cooperative Antioxidant Strategy that Overcomes Ischemic Stroke Damage In Vivo. J. Am. Chem. Soc., 2020.
DOI: 10.1021/jacs.0c03805
https://doi.org/10.1021/jacs.0c03805
5. ACS Nano:顺序特异性递送溶栓剂和神经保护剂用于强化治疗缺血性中风
由血栓阻塞和缺血引起的缺血性中风是一种容易致残甚至致命的脑血管疾病之一。而开发一个可以将溶栓剂和神经保护剂分别送到血栓和缺血半暗带位置的顺序靶向给药系统则有望实现很好的联合效果。受血小板在血栓形成中的重要作用的启发,加州大学顾臻教授和南京医科大学辛洪亮等人开发了一种生物工程纳米血小板(tP-NP-rtPA/ZL006e),用于对重组组织纤溶酶原激活剂(rtPA)和神经保护剂(ZL006e)进行顺序特异性递送。
本文要点:
1)tP-NP-rtPA/ZL006e可经血小板膜介导的靶向作用到达血栓部位,进而上调凝血酶并触发rtPA的释放。随后,原位暴露的Tat肽可以使得纳米血小板穿过血脑屏障进入缺血大脑,实现了对ZL006e的位点特异性递送。
2)体内外实验表明,tP-NP-rtPA / ZL006e在大鼠大脑中动脉闭塞模型中具有很好的抗中风疗效,可显著降低63%的缺血区和72%的活性氧水平。
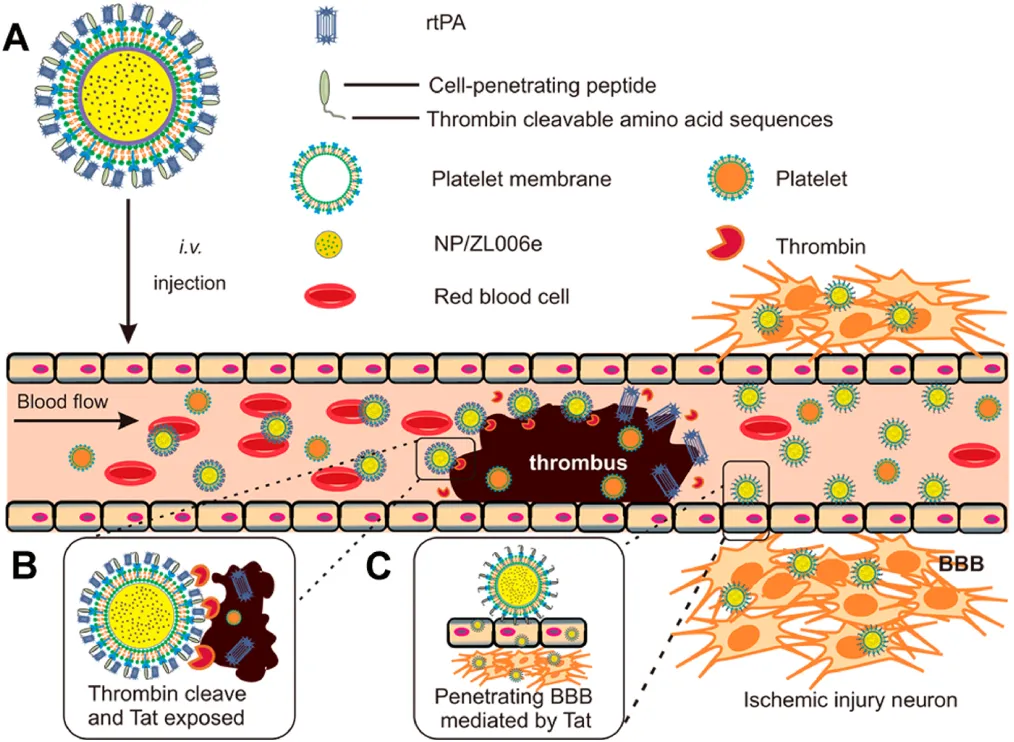

Jianpei Xu, Zhen Gu, Hongliang Xin. et al. Sequentially Site-Specific Delivery of Thrombolytics and Neuroprotectant for Enhanced Treatment of Ischemic Stroke. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01798
https://pubs.acs.org/doi/10.1021/acsnano.9b01798
6. Nano Lett:纳米海绵通过自由基清除和自适应氧调节治疗缺血性脑卒中
急性脑卒中溶栓前的缺氧或溶栓后的氧增强导致高水平的自由基,导致神经细胞的连续损伤。为了治疗缺血性中风,需要清除自由基,并相继调节缺氧和助氧微环境。于此,郑州大学张振中教授、张开翔副教授和Liu Junjie等人报道了一种工程化的纳米海绵(Mn3O4@nanorecomes-T7,MNET),它可以通过自我调节氧气和清除自由基来重塑中风患者的微环境。
由于红细胞的隐形作用以及在T7肽的辅助下在梗塞部位的优先蓄积,血液循环时间长MNET在缺血性中风的两个阶段发挥了独特的治疗作用:(i)溶栓前,通过快速清除自由基和及时供氧来挽救神经细胞;(ii)溶栓后,通过储氧抑制氧增加,清除自由基,避免再灌注损伤。MNET通过对病理微环境的阶段性调节,在缺血性脑卒中治疗中具有诱人的应用前景。

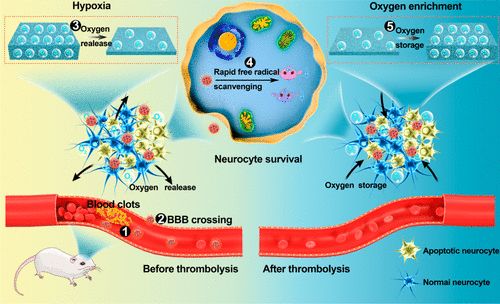
Jinjin Shi, Wenyan Yu, Lihua Xu, Na Yin, Wei Liu, Kaixiang Zhang, Junjie Liu, and Zhenzhong Zhang. Bioinspired Nanosponge for Salvaging Ischemic Stroke via Free Radical Scavenging and Self-Adapted Oxygen Regulating. Nano Letters 2019.
DOI: 10.1021/acs.nanolett.9b04974
https://doi.org/10.1021/acs.nanolett.9b04974
二、害而除之,新型血栓治疗
7. Science Advances:血小板衍生的多孔纳米马达用于血栓治疗
静脉血栓形成,包括深静脉血栓形成和肺栓塞,在世界范围内发病率很高,每年的发病率约为每密耳1-3例,这可能危及生命。目前,静脉血栓形成的治疗主要包括两个阶段。在早期阶段,使用溶栓药来重新血管化,在后期阶段,使用抗凝药来防止血栓形成的再生。静脉血栓形成的治疗困难包括药物的半衰期短,利用率低以及在血栓部位的渗透性差。于此,南京鼓楼医院史冬泉、南京师范大学毛春、Mimi Wan等人开发了一种具有血小板膜(PM)修饰的介孔/大孔二氧化硅/铂纳米马达(MMNM/PM),用于依次靶向血栓溶解和抗凝药物的治疗。
本文要点:
1)由PM上的特殊蛋白质调节,纳米马达靶向血栓部位,然后PM可以在近红外(NIR)照射下破裂以实现所需的顺序药物释放,包括快速释放溶栓性尿激酶(3小时)和缓慢释放抗凝剂肝素(> 20天)。
2)同时,纳米电机在近红外辐射下的运动能力可以有效地促进它们在血栓部位的深层渗透,从而提高保留率。
3)体外和体内评价结果证实,在静态/动态血栓和大鼠模型中,来自PM的靶向能力和来自纳米马达的运动能力的协同作用可以显着增强溶栓作用。
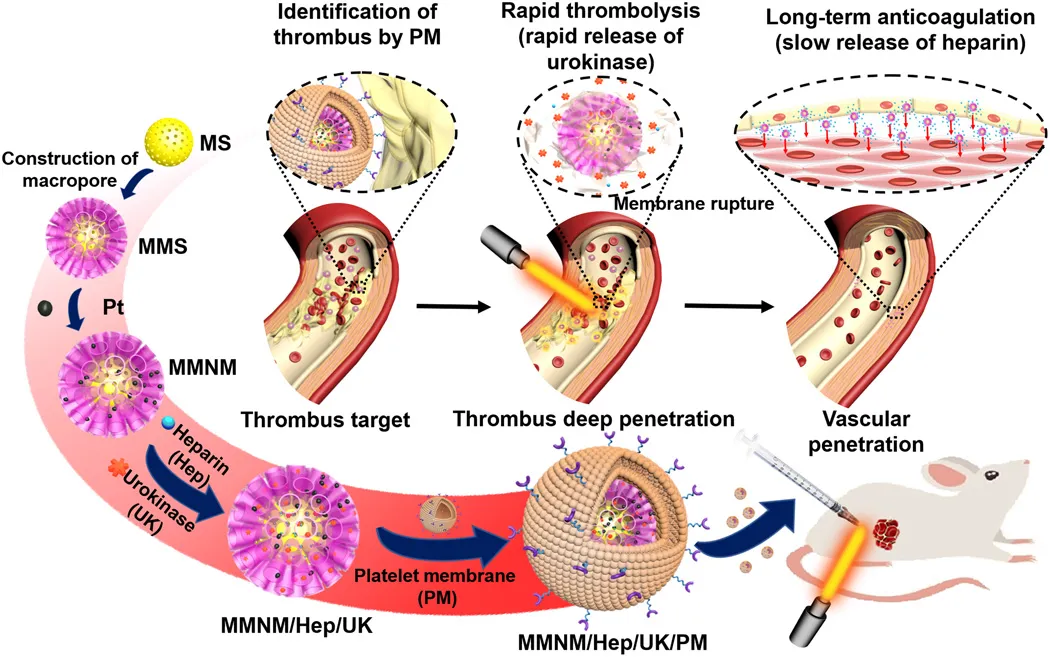

Wan M, et al. Platelet-derived porous nanomotor for thrombus therapy. Science Advances. 2020;6(22):eaaz9014.
DOI: 10.1126/sciadv.aaz9014
https://doi.org/10.1126/sciadv.aaz9014
8. AM:纳米血小板逆转血栓
在涉及血栓形成的疾病中,血液供应的快速切断是全世界发病率和死亡率的主要原因。然而,由于目前的溶栓策略的半衰期短、靶向性低和意外的出血并发症,该疗法提供的结果非常有限。受血小板在止血和病理性血栓中固有作用的启发,国家纳米中心聂广军研究员、李素萍研究员、Zhang Yinlong等人开发了血小板膜伪装的聚合物纳米颗粒(纳米血小板),用于将溶栓药物--重组组织纤溶酶原激活剂(rt-PA)靶向递送至局部血栓部位。
本文要点:
1)量身定制的纳米血小板可以有效地积聚在肺栓塞和肠系膜动脉血栓形成模型小鼠的血栓中,与游离rt-PA相比,其溶栓活性显着增强。
2)此外,在缺血性中风模型中,纳米血小板的治疗效果优于游离rt-PA。体内凝血指标的分析表明,纳米血小板具有较低的出血并发症的风险。所开发的复合仿生纳米血小板为在血栓形成疾病中提高溶栓治疗的疗效和降低出血风险提供了一种有希望的解决方案。
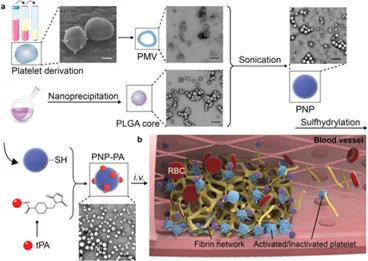

Xu, J., Zhang, Y., Li, S., Nie, G. et al, Engineered Nanoplatelets for Targeted Delivery of Plasminogen Activators to Reverse Thrombus in Multiple Mouse Thrombosis Models. Adv. Mater. 2019, 1905145.
https://doi.org/10.1002/adma.201905145
四、防而避之,血管支架必备条件
9. AFM:类似细胞被的水凝胶涂层用于小直径血管移植物
新型的生物血管导管,例如脱细胞的组织工程化的血管移植物(TEVG),受到高血栓形成的阻碍。为了模拟内皮细胞(ECs)上存在连续糖胺聚糖层的天然血管的抗血栓形成表面,美国耶鲁大学Laura E. Niklason等人建立了透明质酸(HA)修饰的表面,以有效地保护血小板免受胶原蛋白触发的激活。
本文要点:
1)利用直径为4毫米的脱细胞TEVG上存在的胺基,可通过双官能硫醇反应性交联剂构建连续的HA水凝胶涂层,从而避免了非特异性胶原基质的交联。透明质酸水凝胶层重建管腔壁,“隐藏”暴露在血液中的胶原蛋白。
2)体外血液测试表明,HA涂层的脱细胞TEVGs上粘附的血小板、纤维蛋白原吸收和血纤蛋白形成明显低于未涂层的脱细胞TEVGs。HA表面在体外也抑制巨噬细胞粘附。
3)分别在大鼠和犬模型中使用HA涂层的脱细胞同源大鼠主动脉(直径约1.5毫米)和TEVGs,可防止血栓形成,并保持正常的血流。除此之外,实验还观察到再内皮化。HA涂层的TEVGs可能是即用型小直径血管移植物,且具有双重优势:抗血栓形成保护和促进内皮细胞。
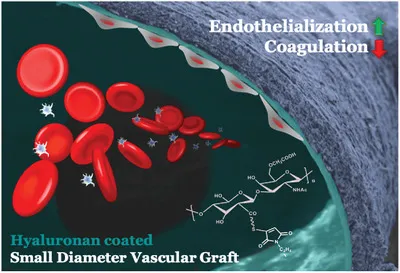

Dimitrievska, S., et al., Glycocalyx‐Like Hydrogel Coatings for Small Diameter Vascular Grafts. Adv. Funct. Mater. 2020, 1908963.
DOI: 10.1002/adfm.201908963
https://doi.org/10.1002/adfm.201908963
10. 血管支架批准上市 | 葛均波院士十年磨一剑终成果

据国家药监局官网和复旦大学中山医院消息,由中国科学院院士葛均波教授领衔团队与山东华安生物技术有限公司合作,历经十余年研发、科研攻关及临床研究随访,研制出具有我国自主知识产权的生物可吸收冠脉雷帕霉素洗脱支架——XINSORB支架,于3月5日通过国家药品监督管理局审批上市。这也是我国最早开始自主研发的生物可吸收支架。

据悉,葛均波教授团队自2005年就开始了生物可吸收支架的研发。2005年,研发团队获得了关键性专利:生物可降解载药物高分子材料支架的制备方法。到了2013年,完成全国首例可吸收支架临床试验。接受XINSORB生物可吸收支架治疗的第一例患者至今已完成5年随访。5年来,该患者未发生任何不良事件,多次复查造影均显示原支架植入部位通畅,支架已几乎完全吸收。
在XINSORB支架上市前,葛均波院士也已带领团队开始了第二代生物可吸收支架的研发,目前该支架已完成长期动物实验随访。而XINSORB支架上市后,也将继续开展上市后临床研究。
另外,在4月9日,国家药品监督管理局经审查,批准了Cook Ireland Limited生产的优先产品“药物洗脱外周血管支架”注册。

该产品为我国首个批准的外周药物洗脱支架,可支撑病变残留狭窄,减少球囊扩张后的弹性回缩发生;紫杉醇涂层可抑制血管平滑肌细胞增殖,预期降低再狭窄发生。该产品可优化目前现有外周血管疾病治疗方案,更好地满足临床需求。药品监督管理部门将加强该产品上市后监管,保护患者用械安全。
 NanoLabs
NanoLabs














