口服递送研究趋势 | Mitragotri院士、刘尽尧、曹智强、师彦平等人最新研究成果进展!
 NanoLabs
NanoLabs
2020-07-02
2020年7月已悄然来临,预示着今年一半的时间过去了。这期顶刊趋势给大家带来的是近期关于口服递送相关的研究。
我们知道,口服给药又是最方便的给药途径,因为与注射相比,它可以提高患者的依从性,对于某些慢性疾病,可以更早地采用治疗方法。而且,口服给药的肽需要在胃肠道的动态pH环境中保持稳定,并且对胃和胰肽酶具有抵抗力。良好的载体设计具有非常广阔的应用价值!
下面是具体内容,用最少的时间掌握最新的研究趋势!
1. Nature Nanotechnology:两性离子胶束在不打开紧密连接的情况下有效地传递口服胰岛素


口服蛋白质药物被认为是改变患者生活的解决方案,需要定期针注射。然而,口服蛋白制剂的临床翻译一直受到药物通过肠粘膜和上皮细胞层的无效渗透的阻碍,导致低吸收和生物利用度,并由于紧密连接开口的安全问题。有鉴于此,美国韦恩州立大学的曹智强等研究人员,报道了一种两性离子胶束平台,其特点是具有模仿病毒的两性离子表面、甜菜碱侧链和极低的临界胶束浓度,使药物穿透粘液和高效的转运蛋白介导的上皮吸收,而不需要紧密的连接开口。
本文要点
1)利用该胶束平台将两性离子胶束胰岛素冻干粉包封在肠溶胶囊中,制备了胰岛素口服制剂原型。
2)该生物相容性口服胰岛素制剂显示出> 40%的高口服生物利用度,提供了微调胰岛素作用模式的可能性,并提供了长期安全性,使得能够口服递送蛋白质药物。

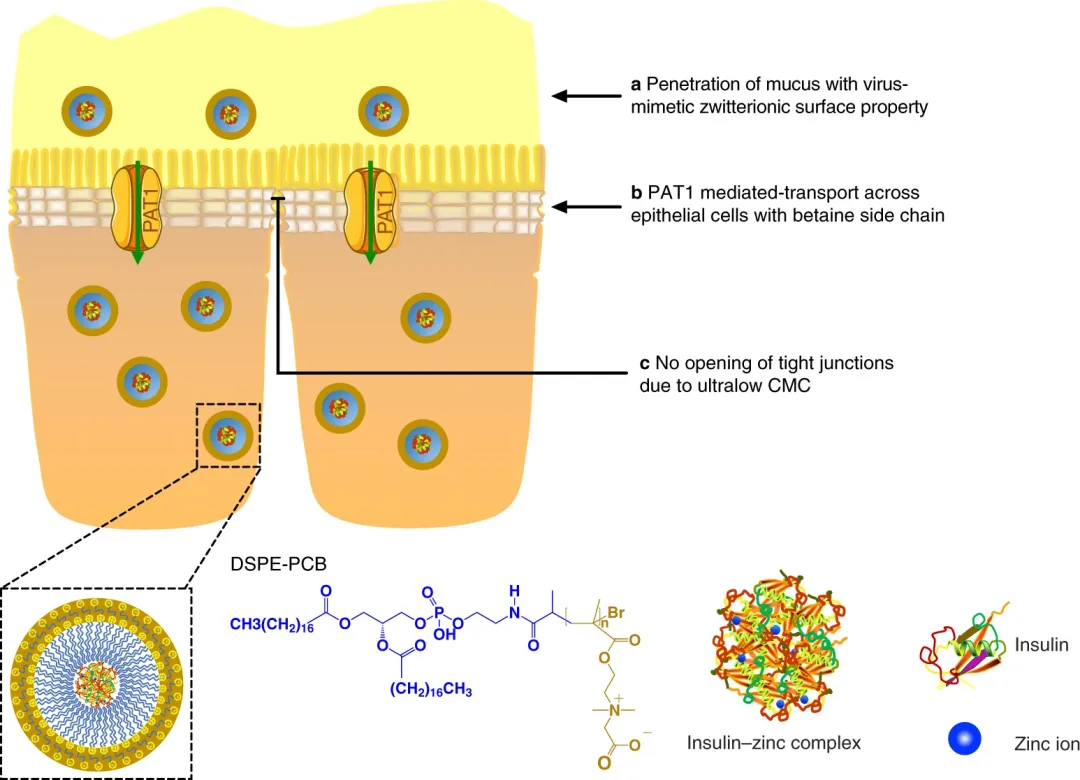
Xiangfei Han, et al. Zwitterionic micelles efficiently deliver oral insulin without opening tight junctions. Nature Nanotechnology, 2020.
DOI:10.1038/s41565-020-0693-6
https://www.nature.com/articles/s41565-020-0693-6
2. Science Advances:通过生物膜的自包被生物启发的肠道菌群的口服递送
将有益的细菌移植到肠道微生物群中可以积极地调节细菌的组成,并且在预防和治疗方面仍然引起人们极大的兴趣。然而,环境的攻击和胃肠道的快速转运时间导致口服生物利用度低和肠道定植受限。于此,上海交通大学刘尽尧研究员等人描述了一种生物启发的策略,即用生物膜自涂层,这种策略赋予了移植的肠道菌群以超强的抵抗力和粘附能力。
本文要点:
1)使用临床枯草芽孢杆菌作为模型益生菌,生物膜包被的益生菌在小鼠和猪中表现出显着改善的胃肠道耐受性和粘膜粘附性。特别地,与猪模型中未包被的细菌相比,包被的益生菌显示出125倍的口服生物利用度和17倍的肠道定植。
2)被包被的细菌具有明显的生存能力和在胃肠道中的驻留能力,在金黄色葡萄球菌定植的小鼠中进一步显示出明显增强的非殖民化作用。用生物膜进行自包被为口服肠道菌群提供了一个强大的平台。

Xinyue Wang, et al., Bioinspired oral delivery of gut microbiota by self-coating with biofilms. Science Advances 2020.
DOI: 10.1126/sciadv.abb1952
https://advances.sciencemag.org/content/6/26/eabb1952
3. AFM:离子液体和深共晶溶剂增强抗体在胃肠道的传递
单克隆抗体(mAbs)目前用于治疗许多疾病,包括癌症、银屑病、关节炎和特应性皮炎等。目前,所有单克隆抗体都是通过静脉注射或皮下注射进行的。有鉴于此,美国哈佛大学的Samir Mitragotri等研究人员,报道了一种新型离子液体和深共晶溶剂胆碱和乙醇酸盐(CGLY)作为胃肠道给药治疗性抗体的平台。
本文要点
1)CGLY维持了TNFα抗体的稳定性和结构。CGLY可显著增强TNFα抗体的细胞外转运。
2)CGLY还降低了肠道粘液的粘度,这是抗体转运的另一个关键屏障。
3)大鼠体内实验结果表明,CGLY能有效地将TNFα抗体传递到肠黏膜和全身循环。
4)一周重复给药研究及组织学和血清生化分析表明大鼠对CGLY有良好的耐受性。
总的来说,这项工作阐明了使用胆碱基离子液体和深共晶溶剂作为局部和系统性治疗性抗体口服平台的前景。

Pavimol Angsantikul, et al. Ionic Liquids and Deep Eutectic Solvents for Enhanced Delivery of Antibodies in the Gastrointestinal Tract. Advanced Functional Materials, 2020.
DOI:10.1002/adfm.202002912
https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202002912
4. Science Advances:高效淋巴系统靶向纳米颗粒环孢素预防狼疮模型小鼠肾小球肾炎
环孢菌素A(CsA)是一种强有力的免疫抑制剂,但由于靶组织分布不良和肾脏毒性,目前尚不能单独用于系统性红斑狼疮(SLE)的治疗。有鉴于此,美国德克萨斯农工大学的M. N. V. Ravi Kumar等研究人员,假设CD71(转铁蛋白受体1)引导的环孢素A(CsA)输送到淋巴系统将改善小鼠模型中SLE的结果,合成了针对CD71的可生物降解的配体偶联纳米粒子[P2Ns-γ-藤黄酸(GA)]。
本文要点
1)GA偶联显著增加了纳米颗粒与CD3+或CD20+淋巴细胞以及与肠道淋巴组织的结合。
2)在口服MRL-lpr小鼠中,P2Ns-GA包裹的CsA淋巴药物释放分别是无配体制剂和商品化CsA胶囊的4-18倍。
3)CsA淋巴生物利用度的提高与抗双链DNA免疫球蛋白G滴度、血浆细胞因子和肾小球肾炎的正常化平行。
因此,本研究证明了纳米颗粒增强淋巴组织靶向性的转化潜力,将CsA转化为SLE的有效单一治疗方法。

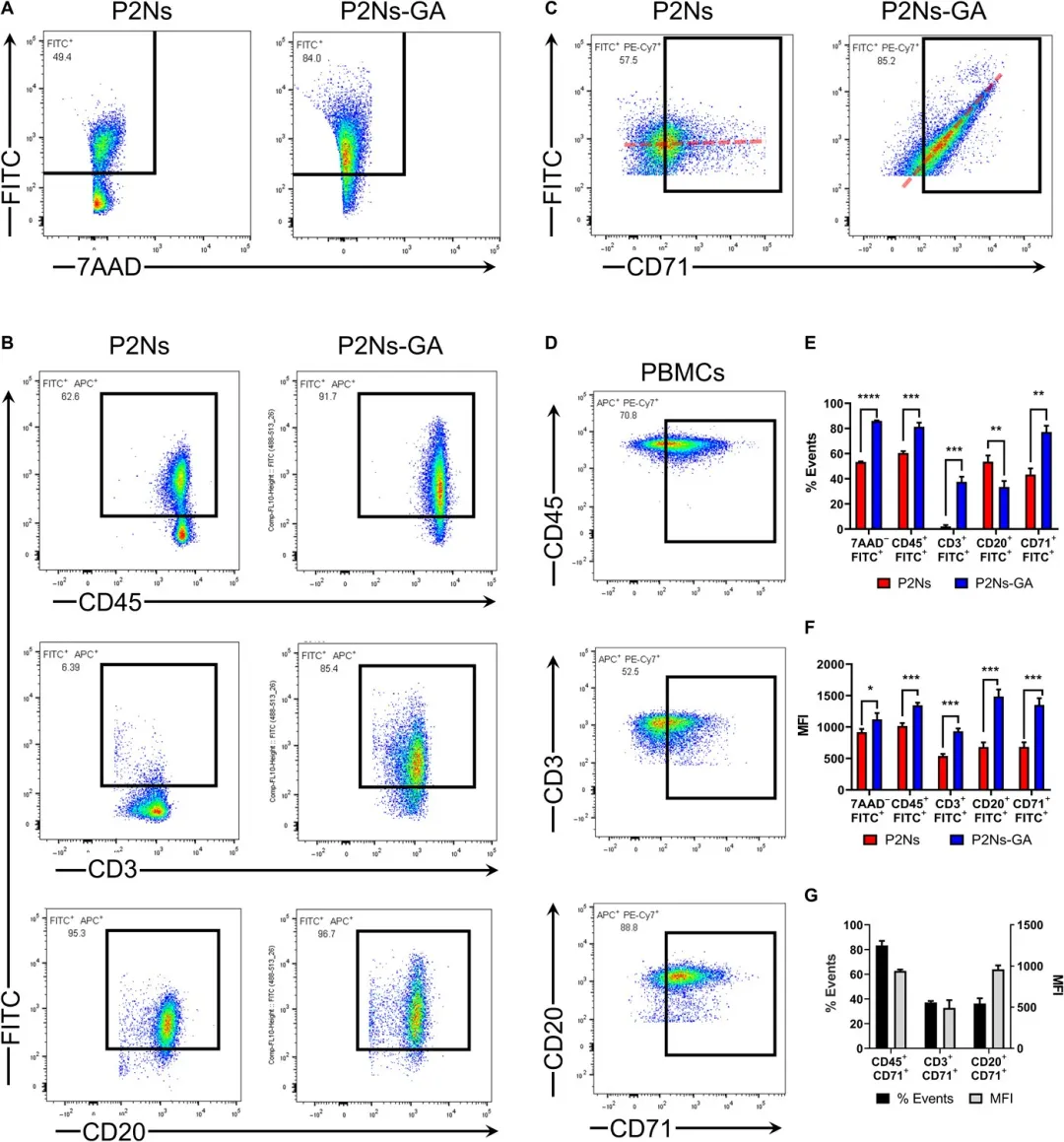
参考文献:
Raghu Ganugula, et al. A highly potent lymphatic system–targeting nanoparticle cyclosporine prevents glomerulonephritis in mouse model of lupus. Science Advances, 2020.
DOI:10.1126/sciadv.abb3900
https://advances.sciencemag.org/content/6/24/eabb3900
5. Biomaterials:改善口服肽递送用于基于肠促胰岛素糖尿病治疗新策略
通过口服途径递送治疗肽仍然是制药业面临的最大挑战之一。近期已报道一种由脂质纳米胶囊组成的经口服途径用于肽递送的替代性改进递送系统。尽管已观察到显著的效果,但仍有必要开发新的策略来加强纳米载体的胰高血糖素样肽-1(GLP-1)的分泌作用和/或延长其体内的降糖作用,以促进其在临床上的转化。有鉴于此,比利时鲁汶天主教大学Ana Beloqui等人开发并比较了不同的脂肪酸靶向脂质和聚合物纳米颗粒,并在体外和正常健康小鼠体内评价了纳米载体对L细胞的刺激作用。
本文要点:
1)在高脂饮食诱导的肥胖/糖尿病小鼠模型中,进一步研究了该药的体内降糖作用,并考察了口服给药频率的影响。在所测试的纳米载体中,只有表面经过DSPE-PEG2000修饰的脂基纳米载体能够显著增强纳米载体的生物效应。在血糖正常的小鼠体内,他们将内源性GLP-1水平提高了8倍。
2)此外,通过长期(一个月)治疗,其能使肥胖/糖尿病小鼠的血糖水平正常化,有效地延长了体内的抗糖尿病作用。最终,当给药频率从每天一次降低到每隔一天一次时,靶向纳米载体同样有效。

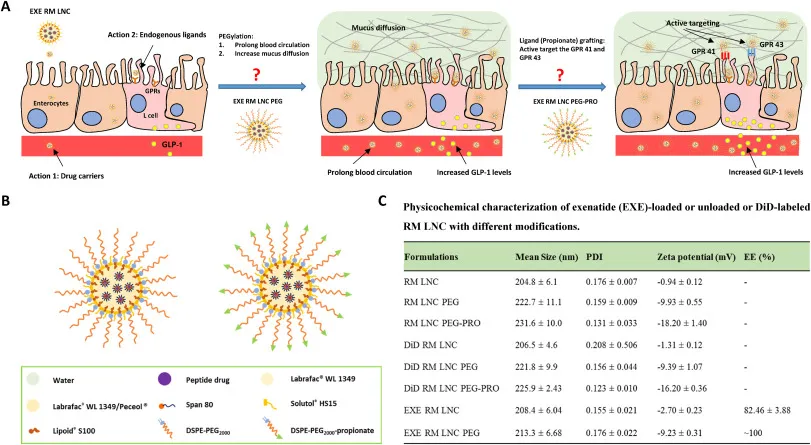
Yining Xua, et al. Targeted nanoparticles towards increased L cell stimulation as a strategy to improve oral peptide delivery in incretin-based diabetes treatment. Biomaterials, 2020.
DOI: 10.1016/j.biomaterials.2020.120209
https://doi.org/10.1016/j.biomaterials.2020.120209
6. Biomaterials:一种口服给药系统可同时递送脂溶性和亲水性化疗药物用于治疗大鼠胰腺肿瘤
胰腺癌的治疗结果仍然不令人满意,为了解决这一难题,台湾清华大学Hsing-Wen Sung、长庚大学Kun-Ju Lin等人提出了一种口服给药系统,该系统自发地引发泡腾反应以形成气泡载体。这些载体同时在小肠内递送脂溶性紫杉醇(PTX)和亲水性吉西他滨(GEM),气泡的破裂促进了药物的肠道吸收。
本文要点:
1)在实验性原位胰腺肿瘤大鼠身上,评估了该口服给药系统的抗肿瘤效果。经静脉途径联合给予等量的PTX和GEM(临床上用于治疗胰腺癌。)作为对照组。经口给药后,亲脂性的PTX首先通过肠道淋巴系统吸收,然后进入全身循环,而亲水性的GEM直接被吸收到血液循环中,最终积聚在肿瘤胰腺组织中。
2)药代动力学研究表明,口服制剂没有任何与静脉注射制剂相关的毒副作用,改变了药物的药代动力学曲线,提高了PTX的生物利用度。
3)口服制剂比静脉注射制剂对肿瘤特异性基质耗竭的影响更大,从而在没有转移扩散迹象的情况下对肿瘤生长产生更大的抑制作用。在提高治疗效果的同时,这种独特的口服化疗方法也有可能应用于门诊病人,大大提高了他们的生活质量。
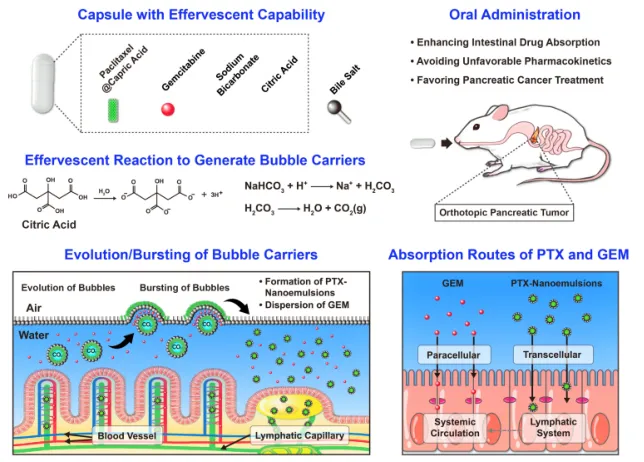

Kuan-Hung Chen, et al. A bubble bursting-mediated oral drug delivery system that enables concurrent delivery of lipophilic and hydrophilic chemotherapeutics for treating pancreatic tumors in rats, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.120157
7. Nature BME:从头开发用于口服的蛋白水解抗性治疗肽
瑞士洛桑联邦理工学院(EPFL)的Christian Heinis等人为了解决这个问题,开发出一种新的方法,整体思想利用了达尔文的物竞天择、适者生存的生物进化思想,该方法可在数十亿个双桥肽中鉴定与目标疾病靶标结合并在胃肠道酶中存活的肽。
具体来讲就是,描述了一种基于噬菌体的进化和选择方法,可以通过药物化学进行优化,用于设计在胃肠道环境中稳定且对胃肠道中的靶受体具有高度亲和力的环肽(并可能用于血液中的靶)。当口服递送给小鼠时,此类靶标特异性肽可抵抗GI蛋白酶,这表明该策略可能适用于开发新型口服肽治疗剂。

Kong,X., et al. De novo development of proteolytically resistant therapeuticpeptides for oral administration. Nat Biomed Eng (2020).
https://doi.org/10.1038/s41551-020-0556-3
8. Anal. Chem:通过多模态成像对靶向结肠的给药过程和生物分布进行精确示踪
中科院兰州化学物理研究所师彦平研究员报道了一种对偶氮还原酶响应的前药AP−N=N−Cy,其前体化合物AP是一种足叶毒素衍生物,可通过多功能的偶氮苯基团与近红外荧光团(Cy)相连接。
本文要点:
(1)这种偶氮基前药不仅可以作为对偶氮响应的近红外探针以实时示踪药物递送过程,而且还可以作为抗癌化合物(AdP)的递送平台。研究发现仅当偶氮还原酶存在的情况下, AP−N=N−Cy中的多功能偶氮苯基会发生裂解进而释放AdP而偶氮还原酶会特异性地在结肠中分泌。偶氮苯基团的引入使得该前药具有独特的荧光开-关性质,并可作为开启Cy荧光的开关。
(2)这种前药可以口服,并且在到达结肠前具有高稳定性和低毒性。考虑到药物释放与荧光开启过程的同步性,实验利用荧光成像方法对药物在体内、体外和体内的递送进行了精确的示踪,并进一步利用成像质谱在分子水平上对AdP和Cy在不同组织中的生物分布进行精确地描绘。这也是首次有研究通过多模态成像的方法在体内对结肠特异性的药物释放和生物分布进行实时精确示踪。

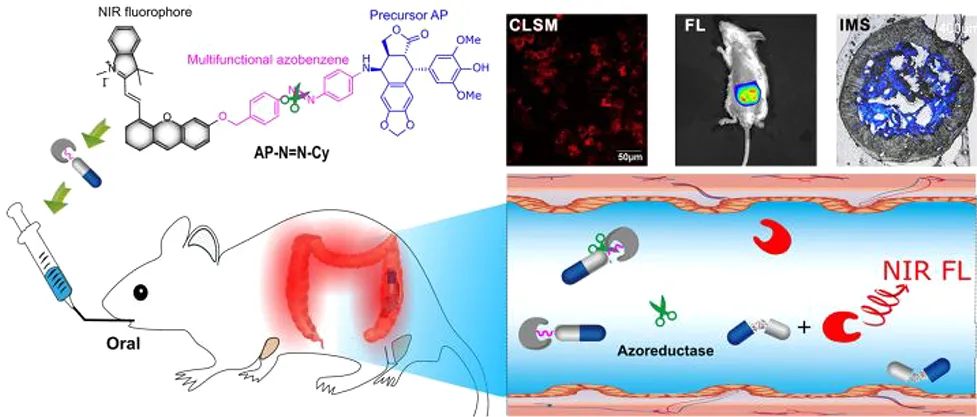
Xiao-bo Zhao. et al. Precisely Traceable Drug Delivery of Azoreductase-Responsive Prodrug for Colon Targeting via Multimodal Imaging. Analytical Chemistry. 2020
DOI: 10.1021/acs.analchem.0c01220
https://pubs.acs.org/doi/10.1021/acs.analchem.0c01220
 NanoLabs
NanoLabs












