四两拨千斤,纳米ICD疗法研究进展 | 刘庄、林君、施进军、余承忠、滕乐生、张振中等人最新研究进展!
 NanoLabs
NanoLabs
2020-08-24
化疗在非特异性杀伤肿瘤细胞时可以通过多种机制增强肿瘤细胞的免疫原性,肿瘤细胞在发生死亡的同时,由非免疫原性转化为免疫原性而介导抗肿瘤免疫应答,此现象被称之为免疫原性细胞死亡(immunogenic cell death, ICD),纳米递送材料近年来也如火如荼地进行该领域的探索,以期更好的达到抗击肿瘤的效果。
本期顶刊趋势,奇物论编辑部归纳总结了近期关于纳米医学与ICD相关的研究,供大家学习和交流!
1. Science Advances:局部鸡尾酒化学免疫疗法以触发强大的全身性抗肿瘤免疫反应
当前,迫切需要开发具有降低的全身毒性和有效功效以对抗具有扩散转移的晚期癌症的化学免疫疗法。于此,苏州大学刘庄等人报道了几种“鸡尾酒”治疗配方,即通过混合免疫原性细胞死亡(ICD)诱导的化学疗法和免疫佐剂以及藻酸盐(ALG)进行局部化学免疫治疗。
本文要点:
1) 免疫检查点阻断(ICB)抗体可以包含在该鸡尾酒中以进行局部注射,也可以通过常规静脉注射使用。
2) 将这种混合物注入实体瘤后,ALG的原位凝胶化将导致局部滞留和药物的持续释放,从而降低全身毒性。
3) 化学疗法诱导的ICD在免疫佐剂的帮助下会触发肿瘤特异性免疫反应,ICB会进一步放大该免疫反应,从而在破坏局部肿瘤、消除转移并抑制癌症复发方面引发有效的全身性抗肿瘤免疫反应。研究人员结合临床上用于肿瘤局部化鸡尾酒化学免疫疗法的药物的策略具有巨大的临床转化潜力。
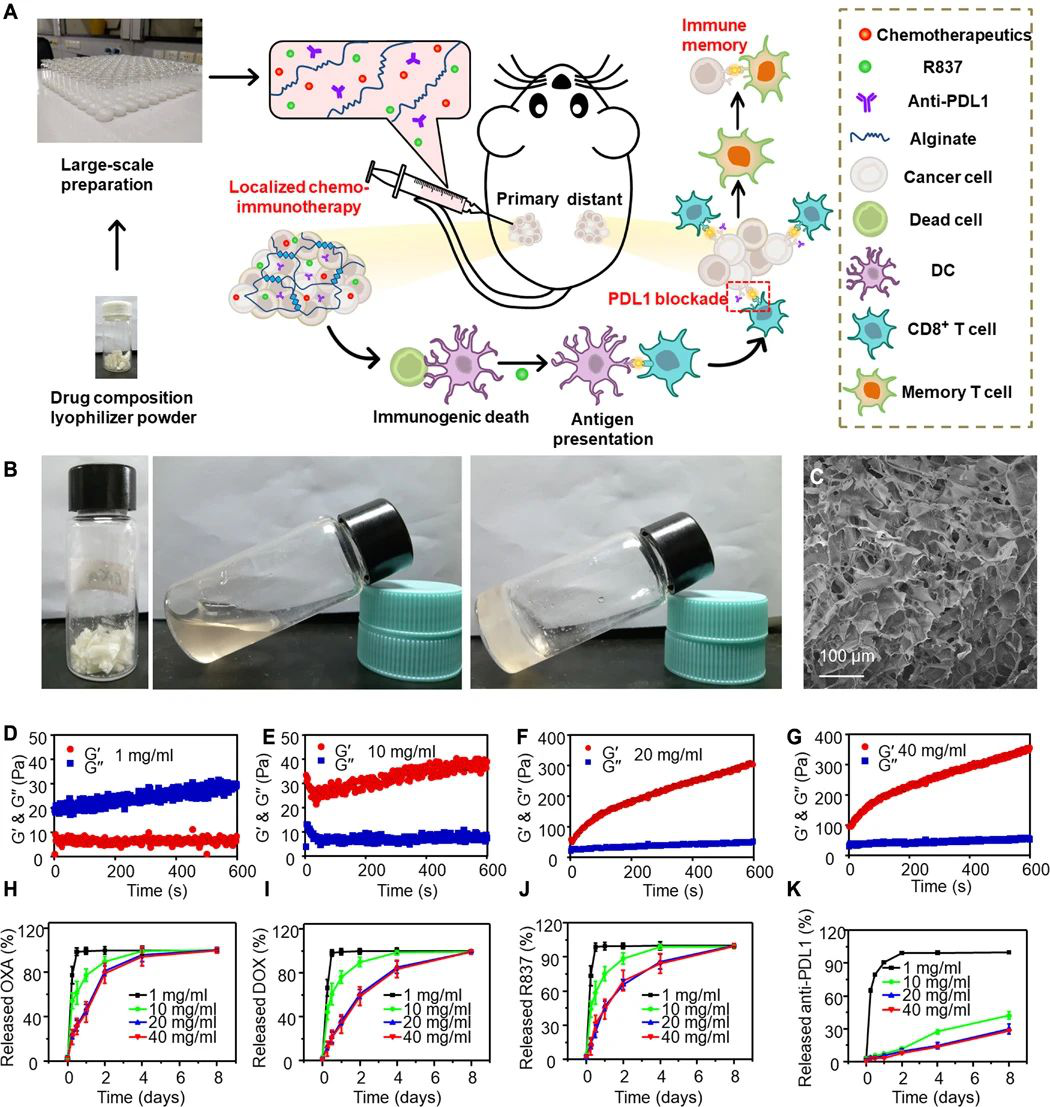
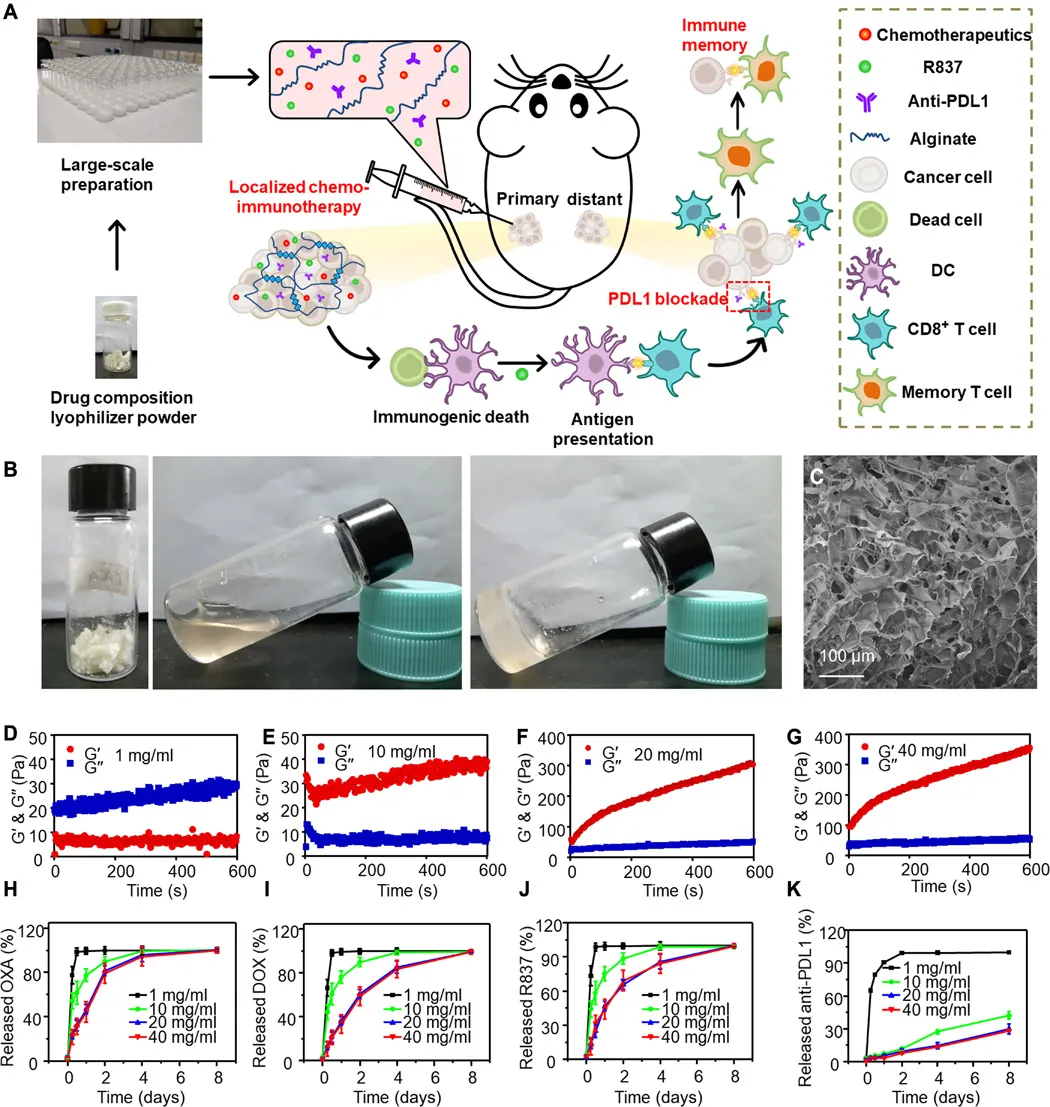
Chao Y, et al. Localized cocktail chemoimmunotherapy after in situ gelation to trigger robust systemic antitumor immune responses. Science Advances. 2020;6(10):eaaz4204.
DOI: 10.1126/sciadv.aaz4204
https://advances.sciencemag.org/content/6/10/eaaz4204
2. Nano Lett:新型纳米诱导剂诱导免疫原性细胞死亡
利用化学疗法诱导免疫原性细胞死亡(ICD)是一种很有前景的肿瘤细胞增敏和诱导抗癌免疫的策略。然而,传统的ICD诱导剂,如化疗药物,由于其较低的肿瘤选择性和严重的副作用,在很大程度上阻碍了其应用。在此,澳大利亚昆士兰大学余承忠、Yannan Yang等人报道了一种新的具有高效力和癌细胞特异性的联合ICD纳米诱导剂,以实现有效的癌症免疫治疗。
本文要点:
1)这种纳米诱导剂由二硫键结合的有机硅纳米颗粒、姜黄素(CUR)和氧化铁纳米颗粒组成,它们可以消耗细胞内的谷胱甘肽,产生羟基自由基,诱导癌细胞特异性的Ca2+耗竭和硫氧还蛋白还原酶的抑制。
2)虽然各组分不能单独诱导ICD,但其互补的药物活性显著增加了细胞内氧化应激和内质网应激。因此,可以诱导ICD和系统抗肿瘤免疫。
综上所述,与传统的ICD诱导剂阿霉素相比,此纳米诱导剂具有显著的ICD诱导活性和癌细胞选择性。
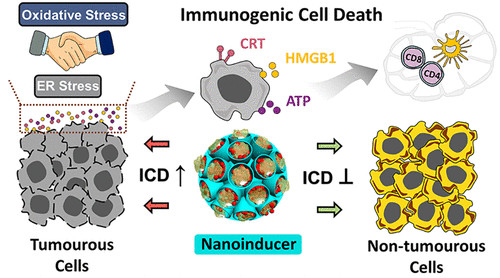
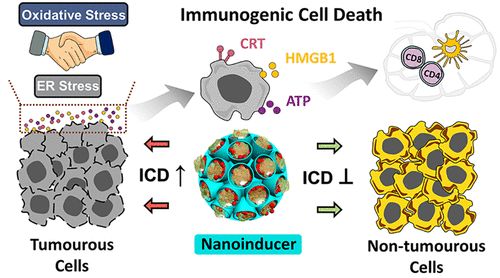
Zan Dai, et al. Eliciting Immunogenic Cell Death via a Unitized Nanoinducer. Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.0c00713
https://doi.org/10.1021/acs.nanolett.0c00713
3. ACS Nano:纳米药物促进anti-PD1治疗根除原位PTEN阴性胶质母细胞瘤
胶质母细胞瘤(GBM)因其低突变率、磷酸酶和张力蛋白同系物(PTEN)缺乏的免疫抑制微环境和高比例的肿瘤干细胞(CSCs)而对免疫检查点抑制具有抵抗力。促进免疫激活肿瘤内信号的纳米药物可以逆转GBM对免疫检查点抑制剂(ICIs)的耐药性,从而促进疗效。在此,日本东京大学Kazunori Kataoka、Horacio Cabral等人应用了pH敏感的表阿霉素胶束纳米药物(这些药物正在进行临床评估),以协同anti-PD1抗体(aPD1)对抗PTEN阳性和PTEN阴性的原位GBM。
本文要点:
1)表阿霉素胶束(Epi/m)与aPD1联合,通过诱导免疫原性细胞死亡(ICD)、清除免疫抑制的骨髓来源的抑制性细胞(MSDCs)和降低肿瘤细胞上PD-L1的表达,将冷GBM转化为高浸润的抗肿瘤免疫细胞的热肿瘤,从而克服了GBM对ICIs的耐药性。
2)Epi/m加aPD1可消除PTEN阳性和PTEN阴性的原位GBM,并提供长期免疫记忆效应。该结果表明Epi/m加aPD1在治疗GBM方面具有很高的转化潜力。
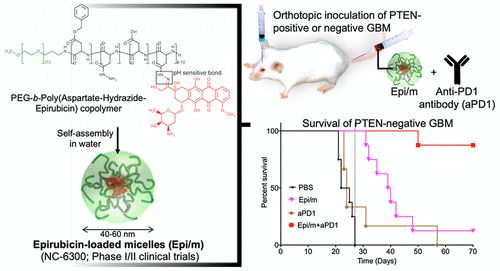
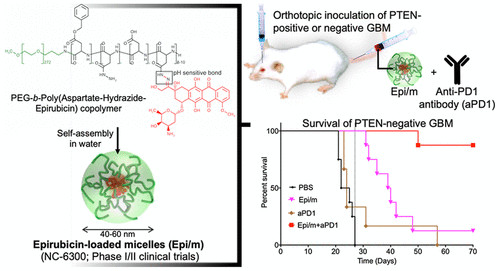
Hiroaki Kinoh, et al. Translational Nanomedicine Boosts Anti-PD1 Therapy to Eradicate Orthotopic PTEN-Negative Glioblastoma. ACS Nano, 2020.
DOI: 10.1021/acsnano.0c03386
https://doi.org/10.1021/acsnano.0c03386
4. Nano Lett.:基于精确杀灭肿瘤种子和规范生长土壤策略的可拆卸纳米颗粒增强化学免疫治疗
基于免疫原性细胞死亡(ICD)的化学免疫治疗虽然能引起免疫应答,但往往注重清除“种子”(肿瘤细胞),而忽视了“土壤”(肿瘤微环境,TME),导致肿瘤生长和转移。在此,郑州大学张振中、Qianhua Feng等人开发了一种可拆卸的核壳纳米平台(DOX@HA-MMP-2-DEAP/CXB)用于化学免疫治疗。
本文要点:
1)由于3-二乙氨基丙基异硫氰酸酯(DEAP)内核的质子化作用,可使其在酸性TME中溶胀释放塞来昔布(CXB),而外壳中的透明质酸@阿霉素(HA@DOX)前药可通过基质金属蛋白酶-2(MMP-2)肽的裂解释放。
2)HA@DOX精确靶向肿瘤细胞以触发ICD。CXB作用于多种免疫细胞对TME进行再调节,如增加树突状细胞(DC)和T细胞的浸润,减少免疫抑制细胞的浸润,消除T细胞与肿瘤细胞之间的物理屏障。作为对比,构建了HA-DOCA/DOX/CXB传统纳米颗粒,DOX@HA-MMP-2-DEAP/CXB具有显著的抗肿瘤作用,显示出提高化学免疫治疗疗效的潜力。
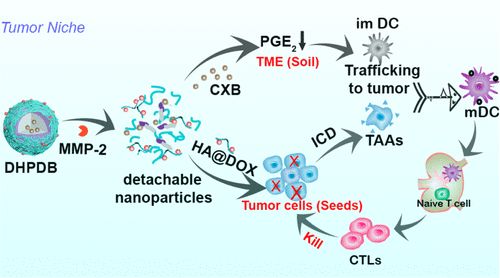
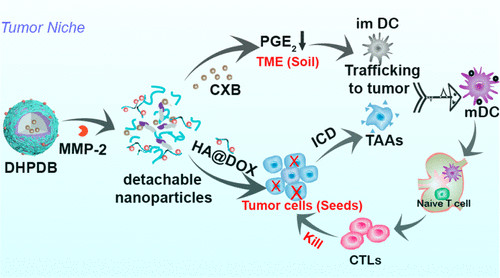
Lei Wang, et al. Detachable Nanoparticle-Enhanced Chemoimmunotherapy Based on Precise Killing of Tumor Seeds and Normalizing the Growing Soil Strategy, Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.0c01415
https://doi.org/10.1021/acs.nanolett.0c01415
5. Nano Lett.:一种缺氧响应性纳米颗粒用于精确癌症治疗
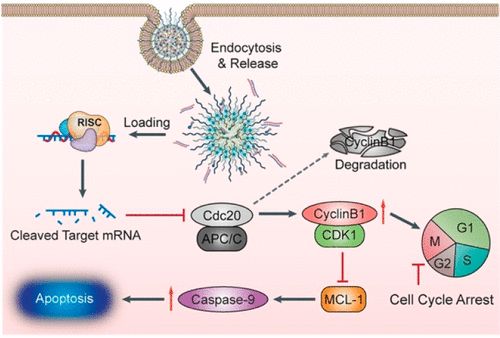
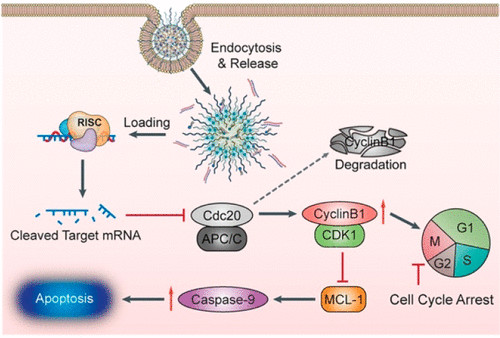
缺氧作为实体瘤的标志,通过调节缺氧相关基因的表达,促进肿瘤生长、转移和治疗耐性。缺氧也代表了一种肿瘤特异性刺激,已被用于开发生物还原性前药和先进的药物递送系统。细胞分裂周期蛋白20(CDC20)在肿瘤发生中起着癌基因的作用,美国哈佛医学院施进军、Omid C. Farokhzad,吉林大学滕乐生等人证实了CDC20 mRNA在乳腺癌患者肿瘤和癌旁组织中显著上调,并与肿瘤缺氧呈正相关。
本文要点:
1)因此,通过2-硝基咪唑修饰的多肽与阳离子脂质类化合物的自组装,制备了一种缺氧响应性纳米颗粒(HRNP),用于乳腺癌治疗中特异性靶向与缺氧相关的促肿瘤发生基因CDC20的siRNA的递送。
2)HRNPs携带的siCDC20充分沉默了CDC20的表达,显示出很强的抗肿瘤作用。
这种通过缺氧响应的RNAi纳米颗粒靶向缺氧相关促肿瘤发生基因的策略可能为癌症治疗提供一种有前途的方法。
Yujing Li, et al. Dual Hypoxia-Targeting RNAi Nanomedicine for Precision Cancer Therapy, Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.0c00757
https://doi.org/10.1021/acs.nanolett.0c00757
6. Angew:MnOx纳米刺用于增强抗肿瘤免疫和抗转移作用
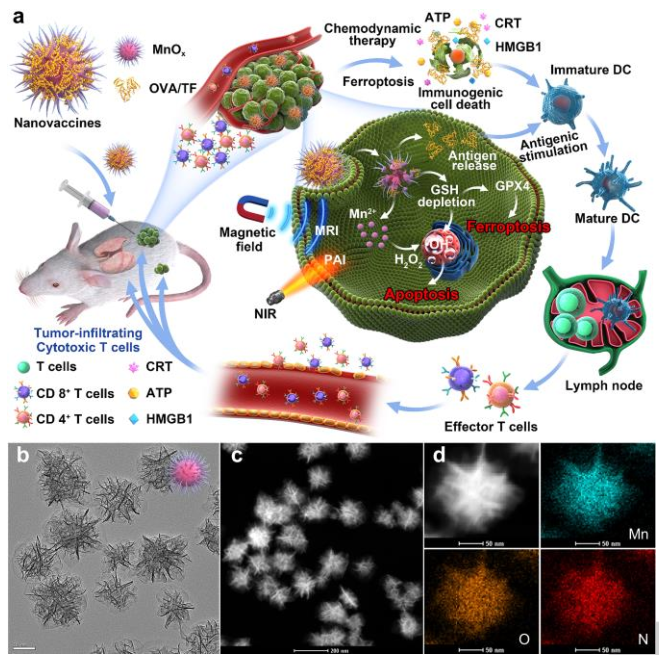
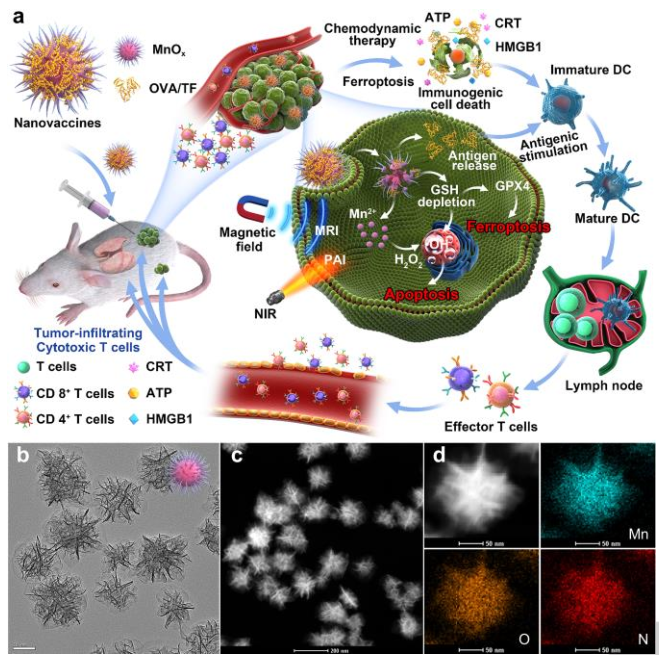
尽管氧化锰纳米材料(MONs)在生物医学中得到广泛应用,但是MONs的固有免疫原性仍不清楚。在本文中,中科院长春应化所林君研究员和马平安研究员等人首先提出了作为肿瘤微环境(TME)反应性纳米佐剂和免疫原性细胞死亡(ICD)药物的MnOx纳米刺(NSs)用于基于癌症纳米疫苗的免疫疗法。
本文要点:
1)具有大介孔结构的MnOx-NSs对卵清蛋白和肿瘤细胞片段具有超高的负载效率。通过化学动力疗法与铁死亡诱导以及抗原刺激相结合的ICD表现出更好的协同免疫增强作用。
2)此外,获得的纳米疫苗不仅可以实现TME响应磁共振/光声双模成像对比,而且还可以有效抑制原发/远端肿瘤生长以及肿瘤转移。
综上所述,所获得的MnOx-NSs不仅可以作为有效抗原载量的免疫佐剂,而且由于Mn2+介导的CDT和GSH的双重诱导而成为ICD药物。ICD与抗原刺激相结合具有较好的协同免疫增强作用。研究人员认为,MnOx佐剂介导的纳米疫苗的成功构建不仅为肿瘤治疗提供了更多的启发,而且加深了对纳米材料内在免疫原性的认识。
Ma, P., et al. (2020), MnOx Nanospikes as Nanoadjuvants and Immuogenic Cell Death Drugs with Enhanced Antitumor Immunity and Antimetastatic Effect. Angew. Chem. Int. Ed.. 2020.
https://doi.org/10.1002/anie.202005111
7. AFM:设计一种治疗诱导的“免疫原性癌细胞死亡”放大器以促进全身肿瘤的消除
免疫原性癌细胞死亡(ICD)使濒死的癌细胞能够调节宿主的抗肿瘤免疫系统,唤醒免疫监视,正引起全世界的关注。因此,有效激活治疗诱导的ICD,对于提高系统抗肿瘤免疫,清除治疗后/远位癌组织具有重要的临床意义。肿瘤治疗中细胞毒性活性氧(ROS)生成的增强与ICD诱导呈正相关,这启发了治疗诱导ICD放大器的设计。在此,澳大利亚新南威尔士大学Zi Gu、昆士兰大学Zhi Ping Xu等人设计了一种纳米杂化放大器(FeOOH@STA/Cu-LDH),用于增强肿瘤免疫治疗效果。
本文要点:
1)FeOOH@STA/Cu-LDH是在含铜层状双氢氧化物(Cu-LDH)的基础上,加入活性氧诱导剂(FeOOH纳米点)、活性氧生成促进剂(用于光热治疗的Cu-LDH)和热休克蛋白抑制剂(STA)而设计的。
2)用该放大器处理4T1肿瘤细胞时,钙网蛋白(CRT,ICD的主要信号之一)在濒死的癌细胞表面移位,在发热型温度(40-42°C)时达到最大值。
3)为了证明这种纳米杂化物的免疫治疗效果,建立了4T1荷瘤小鼠模型。值得注意的是,仅用ICD放大器一次治疗即可根除原发性肿瘤,并在发热型加热时抑制远位肿瘤的生长。另外在治疗1周后在远位肿瘤和脾脏中诱导更多的细胞毒性T淋巴细胞。这项研究为纳米材料介导的肿瘤免疫治疗提供了新的视角。
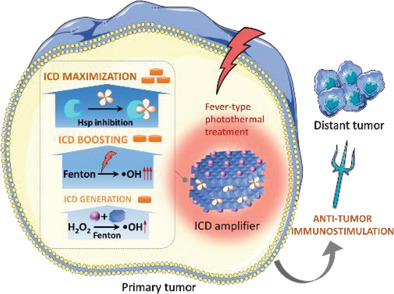
Bei Li, et al. Engineering a Therapy‐Induced “Immunogenic Cancer Cell Death” Amplifier to Boost Systemic Tumor Elimination, Adv. Funct. Mater., 2020.
DOI: 10.1002/adfm.201909745
https://doi.org/10.1002/adfm.201909745
8. Nano Lett.:纳米壳递送STING激动剂至肿瘤细胞内增强抗癌化学免疫治疗
许多有效的抗癌治疗方法的成功归功于诱导癌细胞免疫原性细胞死亡(ICD),ICD可导致内源性危险信号与肿瘤抗原一起释放,从而有效地启动抗癌免疫。在此,中国台湾阳明大学Che-Ming Jack Hu等人描述了一种通过使用空心聚合物纳米壳将干扰素基因刺激因子(STING)激动剂输送到肿瘤细胞中来人工诱导ICD的策略。
本文要点:
1)外源性佐剂在细胞内输送后,随后的细胞毒性治疗会产生免疫原性细胞碎片,在这里称为合成免疫原性细胞死亡(sICD)的过程中,这些细胞碎片在时空上协调肿瘤抗原和STING激动剂。
2)sICD不分化学疗法的类型,能够使外源性免疫佐剂和肿瘤抗原共存,以增强抗原提呈和抗肿瘤适应性反应。
3)在三种小鼠肿瘤模型中,sICD提高了治疗效果并抑制了肿瘤发展。这项研究强调了向癌细胞输送STING激动剂的好处,为新的化学免疫治疗设计铺平了道路。
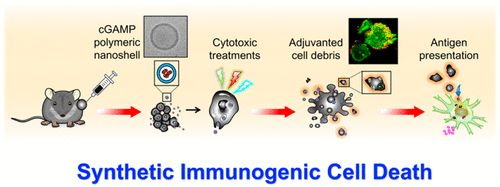
Saborni Chattopadhyay, et al. Synthetic Immunogenic Cell Death Mediated by Intracellular Delivery of STING Agonist Nanoshells Enhances Anticancer Chemo-immunotherapy, Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.9b04094
https://doi.org/10.1021/acs.nanolett.9b04094
 NanoLabs
NanoLabs










