生物力学,再次登上Nature Materials!
 奇物论
奇物论
2021-09-26
我们体内的大多数细胞——无论是骨骼、肌肉还是胰腺细胞——都在微小锚(称为“粘连”)的帮助下锁定在正确的位置。这些强大的锚使用蛋白质链将细胞与胶原蛋白连接起来,胶原蛋白为我们的身体提供结构。锚可以帮助细胞保持原状,并且在很大程度上抵抗对其环境的破坏——但如果细胞变成癌细胞,链条就会断裂,让癌症扩散到身体的其他部位。
具体而言,肌动蛋白细胞骨架是细胞粘附和机械感应的主要驱动因素,因为它能够产生力并感知环境的刚度。在细胞的前缘,突出的Arp2/3肌动蛋白网络的断开产生一个特定的肌动蛋白/原肌球蛋白(Tpm)丝群,控制板状体的持久性。这些细丝与环境粘附力之间的相互作用尚不清楚。
鉴于此,澳大利亚新南威尔士大学Edna C. Hardeman、Peter W. Gunning等人首次发现了链中负责维持连接的特定蛋白质。该研究结果建立在我们对细胞力学的理解之上,并且可能有助于为癌症研究提供新的方向。成果发表在Nature Materials上。

研究人员使用细胞内冷冻电子断层扫描 (cryo-ET) 和操纵基底刚度,发现 Tpm1.8/1.9/肌动蛋白丝对粘附形成的重要贡献及其作为机械传感器的作用。
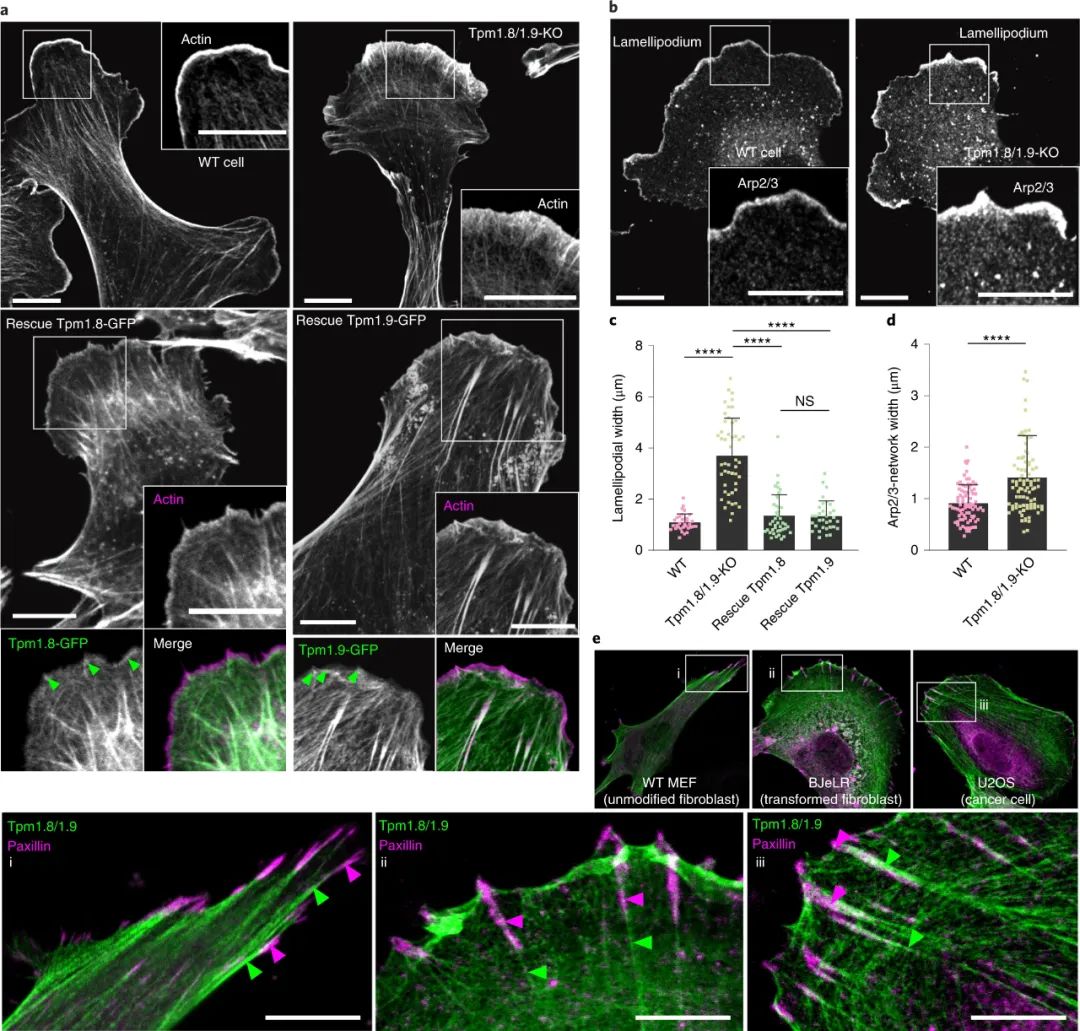
研究人员解析了Tpm/肌动蛋白共聚物的超微结构,并表明它们专门锚定到新生粘连,并且对于粘着斑组装至关重要。Tpm1.8/1.9在转化细胞和癌细胞中的重新表达足以恢复细胞-基质粘附。研究人员证明,Tpm1.8/1.9基因的敲除破坏了背侧肌动蛋白束的形成,阻碍了α-肌动蛋白和非肌肉肌球蛋白IIa(关键机械感受器)的募集。这种损失会导致力产生和增殖缺陷,当细胞在柔软的表面上生长时,这种缺陷会明显逆转。研究人员得出结论,Tpm1.8/1.9抑制转移表型,这可以解释为什么转化细胞在恶性转化过程中自然地下调了这个 Tpm 子集,这也为进一步研究材料表面和癌细胞生物学的交叉点开辟了道路。图|肌球蛋白和α-肌动蛋白背侧应力纤维募集取决于 Tpm1.8/1.9综上所述,在前缘突出过程中,Arp2/3 聚合的肌动蛋白网络产生高度特异性的 Tpm1.8/1.9/肌动蛋白细丝群,其具有保守的线性结构,可锚定到新生粘连,对 FA 组装至关重要。需要 Tpm1.8/1.9 对前缘的独特定位才能在整个薄片上形成背侧应力纤维,从而为肌球蛋白 IIa 收缩性和 α-辅肌动蛋白交联提供底物。通过这种机制,Tpm1.8/1.9/肌动蛋白丝成为机械传感器,可以精细调节刚性传感并抑制软表面上的细胞生长。Tpm1.8/1.9 的消除导致 Arp2/3 活性增加(与肿瘤细胞迁移密切相关,在高级别侵袭性癌症中很常见),2D 和 3D 基质迁移增加,细胞-基质粘附组装和应力纤维形成减少,并增强软基质中的增殖,这是致瘤性的经典标志。Tpm1.8/1.9 水平的下调是转化细胞和癌细胞中的一个自然过程,可能是增强转化表型的有用转移标志物。



Cagigas,M.L., Bryce, N.S., Ariotti, N. et al. Correlative cryo-ET identifiesactin/tropomyosin filaments that mediate cell–substrate adhesion in cancercells and mechanosensitivity of cell proliferation. Nat. Mater. (2021).https://doi.org/10.1038/s41563-021-01087-z
 奇物论
奇物论


