香港中文大学,最新Nature!
 催化计
催化计

第一作者:Hui Zhou
通讯作者:成贵娟、Benjamin List
通讯作者单位:香港中文大学、马克斯·普朗克煤炭研究所
立体选择性酶催化反应在许多化学催化反应中取得优异的效果,特别是小分子的催化转化。基于“锁匙理论”(lock-and-key theory),酶催化剂具有限域效应催化活性位点,这种催化活性位点针对特定结构的反应物具有非常好的适应性,化学催化剂通常缺乏这种限域效应。比如在酮和HCN作为反应物制备氰醇(cyanohydrins)能够通过多种类型的催化剂,包括生物催化剂、无机催化剂、有机催化剂。
有鉴于此,香港中文大学成贵娟、马克斯·普朗克煤炭研究所Benjamin List等报道发展了具有限域催化作用的有机催化剂,能够对包括2-丁酮在内的大量脂肪酮、芳香酮进行对映选择性氰基硅基化,反应在合成医药活性产物的过程中,实现了优异的立体选择性(98:2 e.r.),效果比其他催化剂的效果更好。本文研究结果说明通过设计限域催化剂,能够在小分子的不对称催化转化过程中实现类似酶催化剂的效果,而且这种催化剂具有广泛的底物兼容。
限域催化
酶催化剂在催化反应过程中对底物具有的分辨能力是其他催化方法难以实现的一种独特效应,而且酶催化位点通常只能接受一个底物分子。由于酶催化剂在催化反应过程中形成的区域选择性、立体选择性、对映选择性,为发展其他类型的高性能催化剂提供经验。特别是对于小分子底物的催化反应,发展具有优异选择性(尤其是对映选择性)的催化剂更加困难。
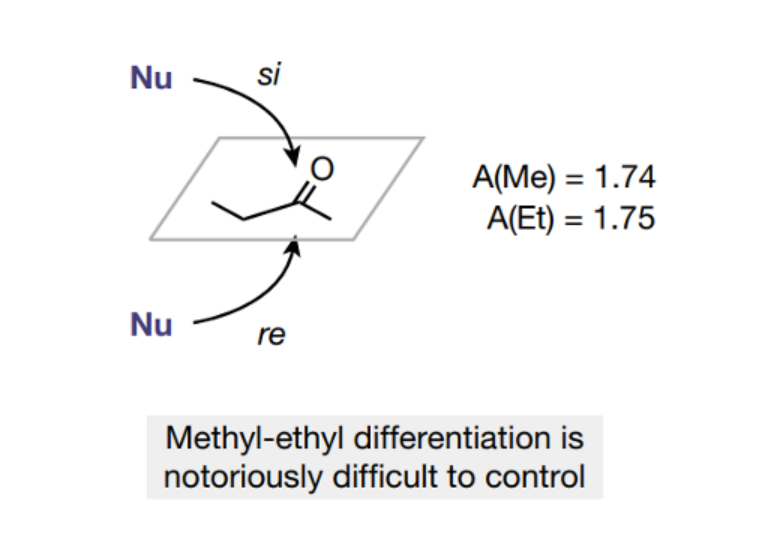
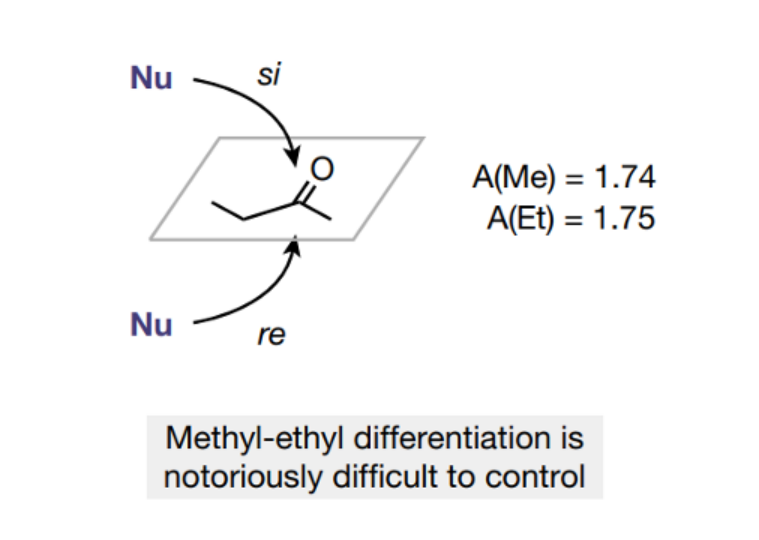
图1. 分析2-丁酮的立体选择性合成的挑战
酮的选择性催化是个非常困难的课题,虽然人们发现酶催化、Ir催化剂催化酮还原为醇的反应能够实现较好的立体选择性,但是通过碳亲核试剂进行的亲核加成反应通常表现非常弱的立体选择性,同样的通过HCN对酮进行加成的反应也面临着立体选择性低的问题。目前人们只能通过羟基腈裂解酶(hydroxynitrile lyases)才能实现较好的氢氰化立体选择性(93.5:6.5),当使用手性硫脲或者Ti-salen催化剂进行催化反应仅仅表现非常低的立体选择性。
有机催化剂设计
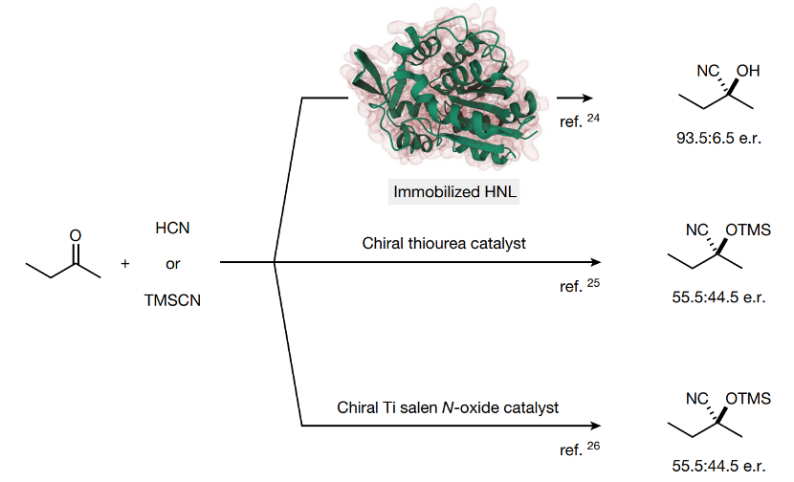
图2. 目前2-丁酮不对称合成的方法学(分别为酶催化、有机催化剂催化、过渡金属催化)
作者根据近期人们发展的限域型强酸催化剂出发,对该反应的立体选择性进行控制。作者之前发现,限域催化剂氮二磷酰亚胺(IDPi, imidodiphosphorimidate)具有比较好的立体选择性催化性能,而且通过硅对抗阴离子具有的导向催化作用,因此作者发现硅烷-IDPi有机催化剂能够催化2-丁酮的不对称氰基硅烷化反应,这种催化剂通过硅基氧羰基对抗阳离子与IDPi阴离子之间的离子成对作用,导致催化剂暴露一个界面,从而在氰基的sp亲核试剂进攻过程中实现立体选择性。
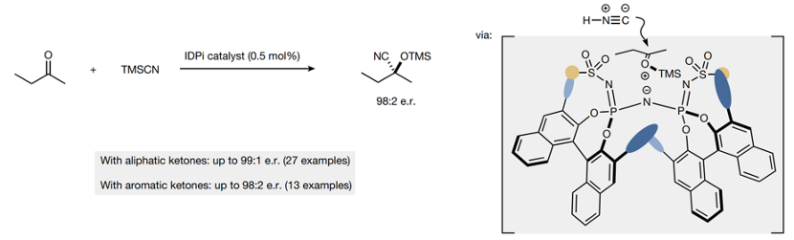
图3. 反应设计
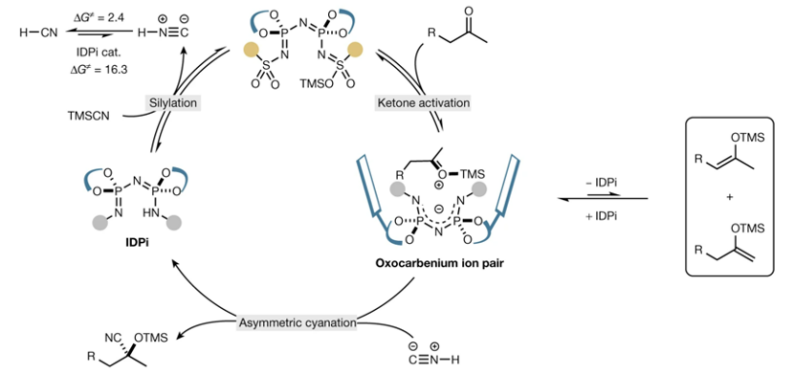
图4. 反应机理
反应条件及底物兼容
通过对IDPi催化剂进行结构筛选,发现IDPi 2具有最好的催化立体选择性和催化活性,实现了化学计量比的产率和98:2的e.r.选择性,催化反应活性是迄今为止报道的最好结果。此外,还发现了多个具有前景的催化剂结构(IDPi 3-5),通过使用IDPi 2-5催化剂,拓展反应的底物兼容,当酮的烷基链长度不同,能够以90-97 %的产率合成氰醇硅醚,同时e.r.选择性达到93:7-98:2。
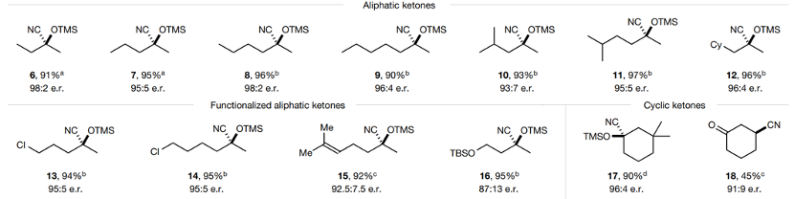
图5. 脂肪酮的兼容
脂肪酮兼容。当底物含有氯取代基,反应生成相应的硅基氰醇化物(13-14),产率分别达到94 %、95 %,立体选择性达到95:5 e.r.;当底物含有烯取代基,反应同样取得较好的反应效果(15),产率达到92 %的同时保持92.5:7.5的e.r.立体选择性;含有保护基团的底物同样能够生成相应产物,含有羟基保护基的底物能够以95 %的产率和87:13的e.r.立体选择性进行。此外,该反应兼容环酮(17)、修饰芳基的脂肪酮(19-29)等反应物,芳基官能团的电子效应和取代效应都不会对反应的立体选择性产生影响。
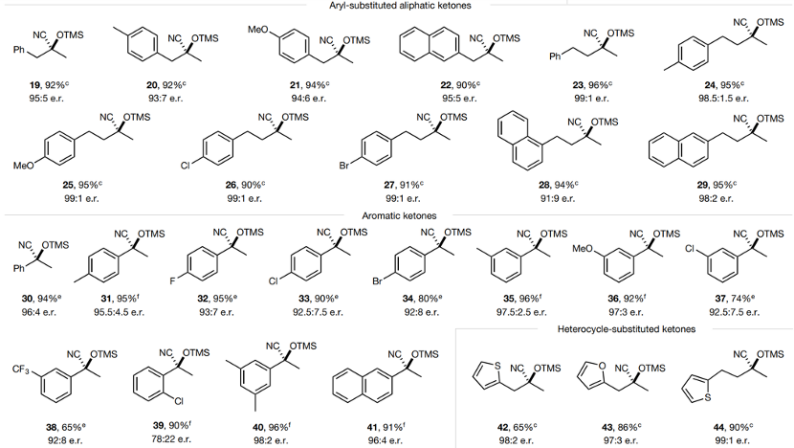
图6. 芳基酮的兼容
芳基酮兼容性。发现含有供电子效应(Me, OMe)、拉电子效应(F, Cl, Br, CF3)官能团的芳香酮都能够进行反应,反应的产率能够达到适中或者优异,能够达到优异的立体选择性,但是可能需要更高的催化剂担载量。
含有碱性适中的杂环取代基(糠基或者噻吩基)的底物同样能够反应(42-44),是西安适中或者优异的产率和较高的立体选择性。类固醇衍生物(45)大分子底物同样展示了优异的产率(92 %)和立体选择性(>95:5)。

图7. 复杂分子的合成
放大量合成。对4-苯基丁烷-2-酮底物进行克级量合成,实现了95 %的产率和95:5 e.r.立体选择性。另外,合成的三级氰酸衍生物分子可以简单的转化为天然产物、生物活性分子、药物活性分子。比如将反应生成的23产物进行衍生化,能够分别生成对应的氨基醇46、氰酸47、有机醛48、恶唑啉49,反应过程具有条件温和、操作简单、步骤简介的优点,而且转化过程中,立体结构得以维持。此外,作者还进行克级量合成消炎药COX-2抑制剂(51)的重要中间体2-羟基-2-甲基丁酸(50)。
参考文献及原文链接
Zhou, H., Zhou, Y., Bae, H.Y. et al. Organocatalytic stereoselective cyanosilylation of small ketones. Nature 605, 84–89 (2022)
DOI: 10.1038/s41586-022-04531-5
https://www.nature.com/articles/s41586-022-04531-5
版权声明:
本平台根据相关科技期刊文献、教材以及网站编译整理的内容,仅用于对相关科学作品的介绍、评论以及课堂教学或科学研究,不得作为商业用途。


