Nature Biomedical Engineering:微针贴片,助力皮肤重回20岁!
 奇物论
奇物论
胶原蛋白是在体内起着重要作用的结构蛋白之一,决定着皮肤的强度、紧致度和弹性。胶原蛋白的生成从40岁开始减少,尤其是在女性绝经后每年胶原蛋白的生成会减少1-2%。60岁以后,胶原蛋白生成的减少将进一步凸显。皮肤中胶原蛋白的减少导致皮肤失去弹性,随之而来的就是皱纹增加,光滑度和柔软度下降,皮肤松弛等,皮肤也会变得非常脆弱。在外界光照紫外线、刺激性挥发物与皮肤炎症疾病等刺激下,皮肤会出现色素沉着、皮肤粗糙等表征。因此,人们一直在寻找有效和安全的解决方案来对抗这些疾病并实现皮肤年轻化。
由于胶原蛋白不可逆转的流失而导致的皮肤萎缩是皮肤老化的标志,许多方法旨在恢复皮肤中胶原蛋白的损失以阻止皮肤的老化。然而,现有包括激光治疗、抗氧化剂与类维生素A等药物技术都无法实现长期的内源性胶原蛋白替代,实现随着时间的推移始终保持皮肤紧致度和弹性。
近日,北京大学深圳健康科学研究院转化医学与创新中心主任的Andrew S. Lee教授与美国德克萨斯大学MD安德森癌症中心Betty Y. S. Kim教授率领各自的团队合力开发展示了一种基于外泌体的COL1A1 mRNA疗法用于光老化皮肤的抗衰老治疗,以取代皮肤胶原蛋白的损失。
此工作建立在2020年该团队同样发表于Nature Biomedical Engineering上题为Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation.的工作基础上。利用先前开发的纳米穿孔技术(CNP),大幅度提高了细胞外囊泡(EV)的mRNA递送和保留效率。进一步通过透明质酸微针贴片在真皮中有效递送负载mRNA的EV,从而诱导动物真皮中胶原蛋白的合成并改善光老化皮肤皱纹。

含COL1A1 mRNA的EV的制备和体外递送:
采用CNP技术以产生高负载人胶原蛋白IαI(COL1A1)mRNA的EV,该技术涉及在纳米孔表面上接种单层新生儿真皮成纤维细胞(nHDF),并用COL1A1-GFP质粒纳米转染细胞,在转染后的第二天从培养基中分离出EV。CNP处理的细胞与使用标准批量电穿孔(BEP)处理的细胞相比,每个细胞的EV数高10倍。通过纳米颗粒跟踪分析(NTA)确定的EV的直径约150 nm。蛋白质印迹实验表明,CNP处理组外泌体(CD9,CD63,TSG101)和微泡(ARF6)生物标志物的表达明显高于未处理组,证实了分泌EV的增加。RT-qPCR显示,CNP处理分泌的EV的COL1A1 mRNA水平比BEP高200倍和比非转染细胞高3000倍。
进一步评估含COL1A1 mRNA的EVs(COL1A1-EVs)在体外的治疗潜力。观察到成纤维细胞的增殖随着COL1A1-EV处理以剂量依赖性方式增加。COL1A1-EVs处理的成纤维细胞中观察到COL1A1蛋白表达升高,通过定量PCR和蛋白质印迹分析分别测量的胶原蛋白mRNA表达和胶原蛋白水平升高。此外,COL1A1-EV处理后COL1蛋白的前体前胶原I显着增加。EV细胞摄取的共聚焦显微镜成像表明,EV递送mRNA到受体细胞中是由网格蛋白介导的内吞作用介导的,并且能够溶酶体逃逸。综上所述,这些发现表明功能性COL1A1 mRNA可以通过CNP稳定地包封在EV中,并且该COL1A1-EV递送系统可以在体外显着增加COL1A1蛋白表达。
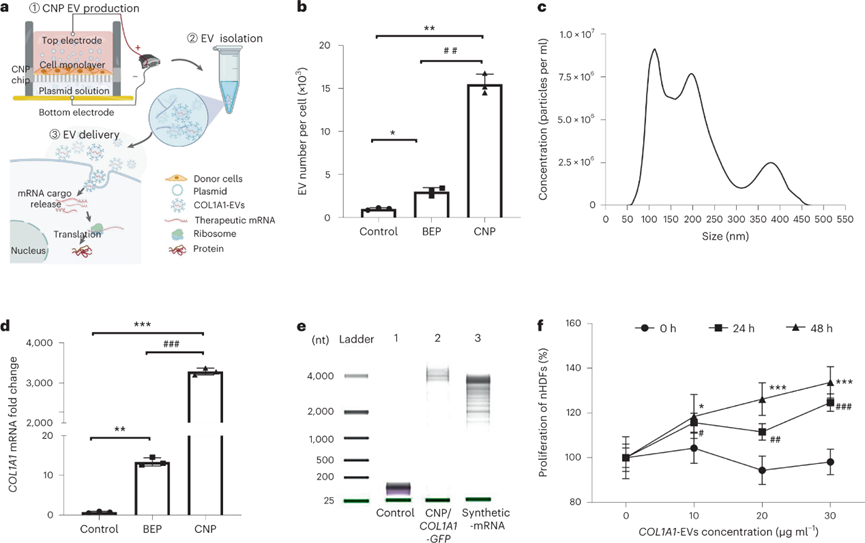
图|CNP制备装有大量COL1A1 mRNA的EV
COL1A1-EV递送后COL1A1 mRNA表达和蛋白质翻译:
为了解EV介导的COL1A1 mRNA递送代谢动力学,将一定拷贝量的COL1A1 mRNA COL1A1-EV注射到小鼠的真皮中。发现COL1A1 mRNA在注入后12小时在局部皮肤组织中显着升高,随后24与48小时显着降低,并在96小时恢复到基线水平。进一步评估COL1A1 mRNA诱导胶原蛋白体内翻译。通过免疫荧光显微镜观察到,注射后12 h就观察到GFP与COL1A1荧光,在给药后4天出现荧光峰值。这些发现表明,较低剂量的COL1A1-EV递送导致受体组织中COL1A1蛋白表达在3-4天达到峰值,在注射后第30天降至基线水平。
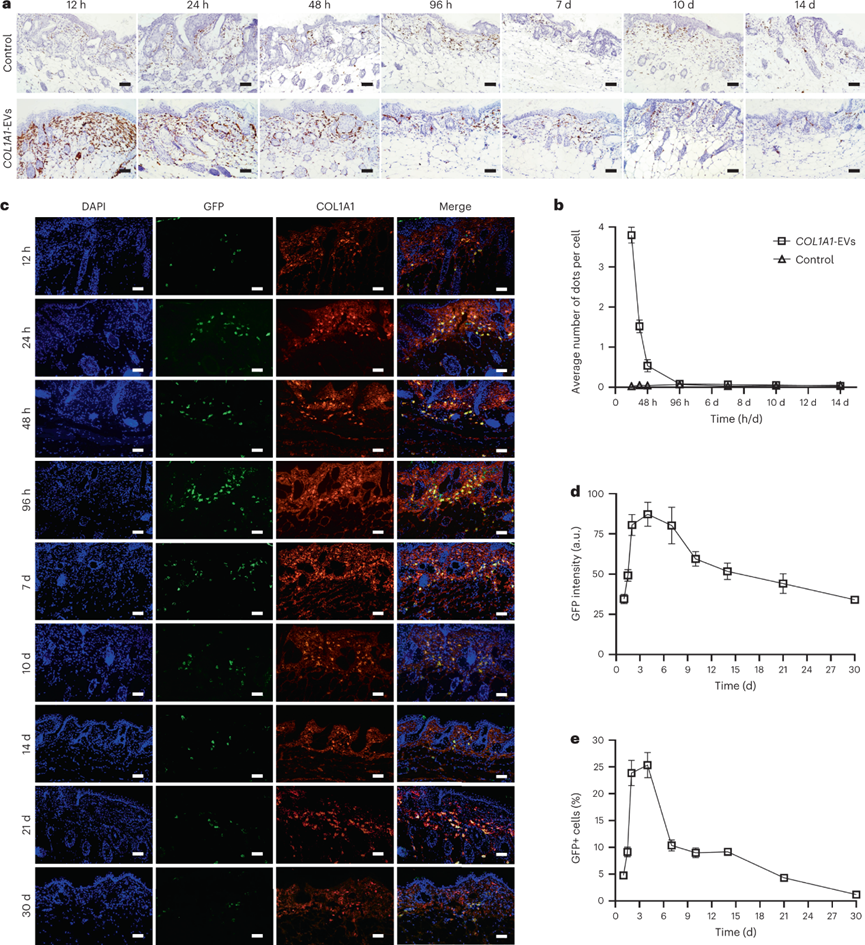
图 COL1A1-EV mRNA递送和小鼠皮肤蛋白质形成的体内动力学
COL1A1-EVs在胶原蛋白消耗皮肤光老化模型中的治疗:
真皮光老化的特征是阳光、和紫外线照射破坏皮肤中的胶原蛋白和细胞外基质蛋白,从而导致皱纹的形成。使用该模型验证COL1A1 mRNA EVs在体内对抗降解胶原蛋白的能力。治疗期间真皮皮肤皱纹的显微镜摄影显示,与生理盐水对照组相比,到第28天,COL1A1-LNPs,空载EV和视黄酸组的皱纹数量和面积略有减少。相比之下,用COL1A1-EVs处理的光老化小鼠在治疗开始后第7天开始表现出皱纹数量和面积的减少,从第14天开始显着减少到与假照射对照组中观察到的水平相似。值得注意的是,COL1A1-LNPs组的皱纹数量和面积也减少了,尽管这种效果不如COL1A1-EV那么明显。用COL1A1-EV和COL1A1-LNPs治疗的皮肤也表现出更高的弹性和紧致度。
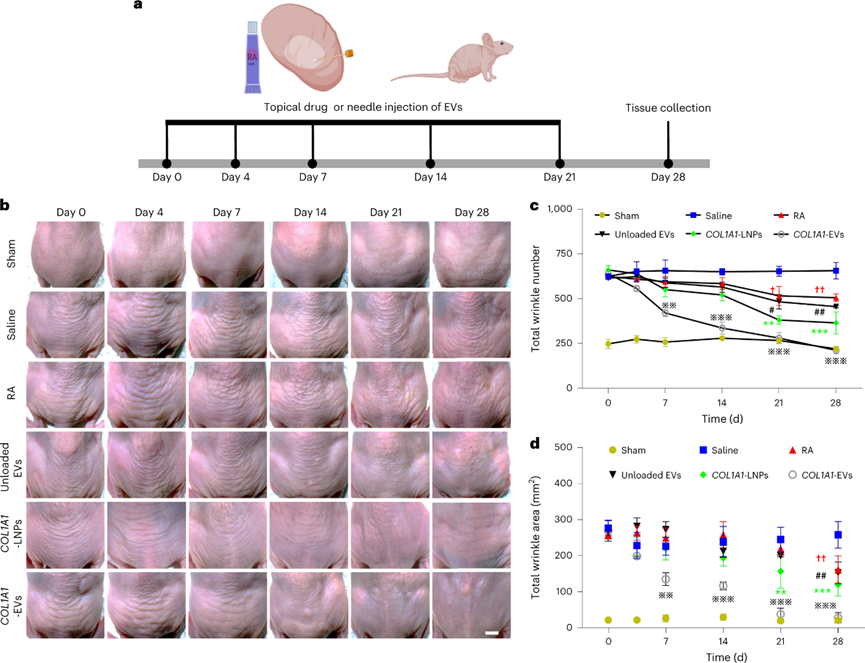
图 COL1A1-EV mRNA递送可减少紫外线照射光老化模型中的真皮皱纹
评估COL1A1-LNPs和COL1A1-EVs的免疫原性副作用。与阴性对照和COL1A1-EV处理的皮肤相比,用COL1A1-LNPs处理的皮肤表现出发红和肿胀。组织的流式细胞术和酶联免疫测定进一步揭示了接受COL1A1-LNP的组织中以中性粒细胞为主的大量白细胞浸润和高水平的炎性细胞因子。相比之下,接受COL1A1-EV治疗的组织没有表现出强烈的炎症反应。
进一步评估COL1A1-EV递送治疗后真皮胶原蛋白的表达,在治疗开始后第28天从切除皮肤进行组织学分析和荧光强度定量。COL1A1-EV处理后COL1A1蛋白表达相对于其他组显着恢复。Masson 三色染色证实,给予 COL1A1-EV 的小鼠的胶原蛋白和真皮厚度水平更高。

图 组织学分析COL1A1-EV mRNA治疗光老化小鼠真皮中的胶原蛋白
基于微针的EV mRNA递送系统设计:
由于COLA1-EV治疗效果仅维持1个月,希望可以通过设计透明质酸微针(COL1A1-EV MN)来改善治疗持续时间与有效性,以改善EV介导的mRNA组织递送。COL1A1-EV微针贴片的每根针都模制成圆锥形,其底部的圆形直径为400μm,高度为1000μm。15%透明质酸浓度的COL1A1-EV MN载荷断裂力被证实高于皮肤穿透所需的最小平均力,H&E染色也证实微针确实穿过角质层进入真皮。为了递送到组织中,将COL1A1-EV MN贴片压入小鼠的背侧皮肤中,并在15分钟后取出微针基底。在此期间,微针完全溶解,在给药部位没有可见的皮肤刺激或痕迹。
为了比较微针输送EV的组织分布与胰岛素注射器注射EV的组织分布的区别,用DiI在小鼠背侧皮肤给药。组织分布分析显示,注射器针头注射导致EV输送不均匀,在真皮和皮下的特定区域聚集,而微针递送的EV在真皮和皮下分散更好。冷冻电镜对EV膜完整性的评估显示,与注射器针头相比,微针贴片输送的EV更加完整。荧光成像证实注射法前4天递送的EV和微针递送的EV之间的DiI信号相似。然而,COL1A1-EV 微针组在第 4 天和第 7 天具有显着更高的荧光信号,持续到给药后第 10 天。这些发现表明,使用微针贴片可以改善EV在组织中的长期保留。

图 用于改善组织中EV分布的微针输送系统
COL1A1-EV微针递送的治疗效果:
使用COL1A1-EV微针贴片递送COL1A1-EVs,以验证该治疗策略是否改善光老化小鼠皮肤中的体内胶原蛋白再生。相对于注射器注射实现35天的治疗效果,COL1A1-EV MN微针贴片可在70天内显着减少皱纹面积和数量。注射和微针治疗均可在治疗后长达1个月内减少皱纹长度和深度,但只有用微针处理的小鼠在长达2个月的时间内表现出皱纹长度和深度的显着持久减少。
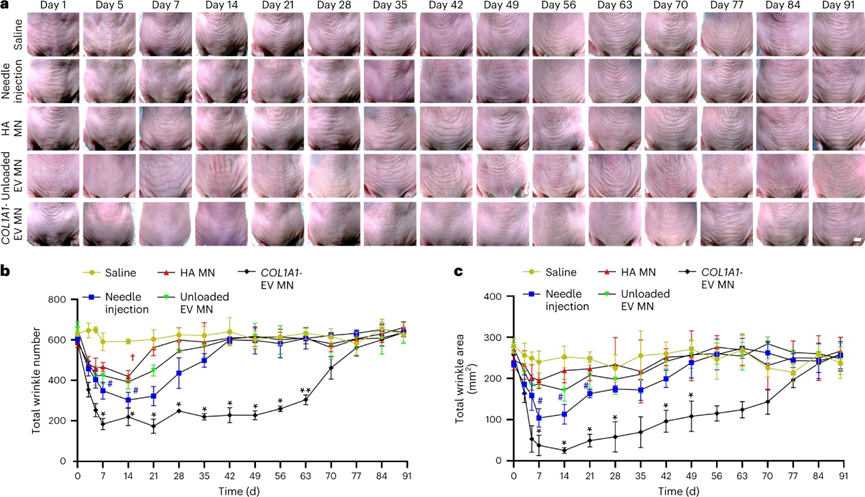
图 通过COL1A1-EV微针输送COL1A1-EV改善光老化皮肤的长期治疗
对治疗后采集的皮肤样本的组织学分析证实,注射组与微针组小鼠的真皮和皮下均在1个月内可以观察到GFP与COL1A1蛋白荧光信号。然而,到2个月的时间点,只有COL1A1-EV微针队列中的小鼠在真皮和皮下表现出GFP与COL1A1信号。在给药后3个月,所有组的皮肤样本均未显示任何GFP与COL1A1信号。量化COL1A1与GFP免疫荧光强度,显示微针组在第30-60天呈有效治疗,第70-90天恢复到治疗前基线。并且在所有队列中,COL1A1-EV MN组具有最丰富的胶原纤维和最高的真皮厚度。综上所述,通过COL1A1-EV MN系统封装和递送COL1A1 mRNA可以延长光老化皮肤中的胶原蛋白再生时间,其持续时间是注射器针头递送时间的两倍以上。

图 通过COL1A1-EV MN递送COL1A1-EV mRNA导致皮肤长期蛋白质再生
小结:
细胞外囊泡因其生物相容性、低免疫原性和来自健康人体细胞等固有特性而成为下一代药物递送系统。尽管如此,大多数专注于核酸递送领域的研究都将如microRNA和小干扰RNA的小分子进行负载,而较大的核酸很少被评估,因为难以将它们加载到EV中。基于作者团队前期开发的一种mRNA加载技术——CNP,可以大规模生产含有完整内源性mRNA的EV,用于核酸治疗。CNP能够将高拷贝数的COL1A1 mRNA(~4,000+ nt)加载到EV中,这是其他常用方法无法实现的。
与基于DNA的基因疗法相对持久的表达相比,mRNA疗法可能有助于推进基因治疗并降低不良事件的风险,因为mRNA保留在细胞质中,而不会渗透到细胞核中。因此,基于mRNA比基于DNA和基于病毒的基因疗法具有优势。然而,mRNA疗法的临床转化仍然有限。为了使mRNA治疗适应长程治疗,作者团队进一步开发了一种用于递送COL1A1-EV的微针阵列,以使EV均匀分布到局部组织中,同时减少膜破裂。通过将 EV 集成到透明质酸微针生物材料中,能将 COL1A1 的胶原蛋白治疗效果延长至 60 天以上。
COL1A1-EV MN临床应用的未来挑战包括优化微针几何形状以及优化储存条件,因为mRNA在高于-80°C的保存条件下会快速降解。COL1A1-EV MN未来可以向即用型医疗器件方向发展,并配合其他试剂或方法提高mRNA的运输保存温度,这将大幅度提高COL1A1-EV MN系统的临床实用性。同时可以通过改变内部携带的mRNA来扩展该系统的治疗应用。该系统也适用于负载其他类型的核酸分子,如miRNA和siRNA,甚至多肽和蛋白质也可行。与LNP和腺相关病毒(AAV)相比,EV递送系统的相容性更加良好、副作用有所改善,该系统存在发展成为治疗通用核酸载体的强大潜力。
参考文献:
Yi You, Yu Tian, Zhaogang Yang, et al. Intradermally delivered mRNA-encapsulating extracellular vesicles for collagen-replacement therapy. Nat Biomed Eng. 2023 Jan 12.
https://www.nature.com/articles/s41551-022-00989-w
Zhaogang Yang, Junfeng Shi, Jing Xie, et al. Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation. Nat Biomed Eng. 2020 Jan;4(1):69-83.
https://www.nature.com/articles/s41551-019-0485-1
版权声明:
本平台根据相关科技期刊文献、教材以及网站编译整理的内容,仅用于对相关科学作品的介绍、评论以及课堂教学或科学研究,不得作为商业用途。


